
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
分析 (1)由电离能可知,A可失去3个电子,B可失去2个电子,则A为Al,B为Mg;
(2)根据紫外光的光子所具有的能量与蛋白质分子中重要化学键断裂所需能量比较分析;最简单的氨基酸为甘氨酸,根据杂化理论进行判断;
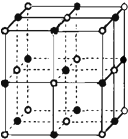
(3)离子晶体的晶格能越大,熔点越高;根据CaO晶胞的结构,可以确定一个Ca2+周围和它最邻近且等距离的Ca2+有数目;
(4)根据钒离子、铬离子的未成对电子判断.
解答 解:(1)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则A为Al,B为Mg,同周期元素从左到右元素的电负性逐渐增强,则电负性A>B,
故答案为:+3;>;
(2)波长为300nm的紫外光的光子所具有的能量约为399kJ/mol,比蛋白质分子中C-C、C-N和C-S的键能都大,所以波长为300nm的紫外光的光子能破坏蛋白质分子中的化学键,从而破坏蛋白质分子,最简单的氨基酸为甘氨酸,其结构简式为NH2-CH2-COOH,甘氨酸中羧基中碳原子为 sp2 杂化,另一个碳原子为 sp3 杂化,
故答案为:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;sp2和sp3杂化;
(3)KCl、CaO、这2种晶体的结构与NaCl晶体结构相似,离子半径越小,离子所带电荷越多,晶格能越大,熔点越高,CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-,Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能CaO>KCl,故熔点CaO>KCl,在CaO晶胞中Ca2+周围有六个O2-,O2-周围有六个Ca2+,根据晶胞的结构可以看出,如果以体心上一个Ca2+为究对象,和它最邻近且等距离的Ca2+分布在晶胞每个棱边中点上,共有12个,
故答案为:CaO>KCl;离子半径越小,离子所带电荷越多,晶格能越大,熔点越高;12;
(4)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6,无未成对电子,CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2两对未成对电子,金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,则合作录音带磁粉原料的是CrO2,
故答案为:CrO2.
点评 本题考查了化合价和电负性的判断、核外电子排布式的书写、晶体结构等知识点,题目难度中等,注意书写基态原子的核外电子排布式要遵循构造原理,注意把握根据元素的电离能判断原子最外层电子数的方法.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛的同分异构体共有4种 | |
| B. | 2-氯丁烷与NaOH乙醇的溶液共热的反应产物中一定不存在同分异构体 | |
| C. | 3-甲基-3-乙基戊烷的一氯代物有5种 | |
| D. | 分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应的同分异构体共有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为2NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油的主要成分是高级脂肪酸 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 工业上电解饱和食盐水的阴极反应:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有原子数为2NA | |
| B. | 0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA | |
| C. | 常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
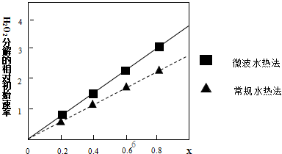
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com