
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出:| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水的物质的量为1mol |
| B、53g Na2CO3含离子数为0.5NA |
| C、32g甲烷的体积是44.8L |
| D、NA个N2分子的质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓硫酸体现了氧化性和酸性 |
| C、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是SeO2>H2SO4(浓)>I2 |
| D、反应①中每有0.6molI2生成,转移电子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
(1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:| 13 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
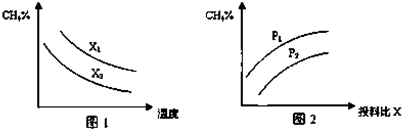
查看答案和解析>>
科目:高中化学 来源: 题型:
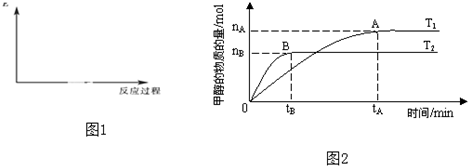
| nA |
| tA |
| C(H2O)?C(CH3OH) |
| C(CO2)?C(H2) |
| nH2 |
| nCH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
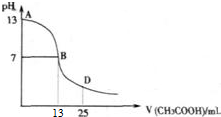
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com