
| A��Ksp��AgI��С��Ksp��AgCl��g��AgI����ת��ΪAgCl | ||||
| B�������������Ksp���Խ���������Խ����ת��Ϊ�����ܵ������� | ||||
| C��AgI��AgCl��������ˮ������AgCl����ת��ΪAgI | ||||
D�������£�AgCl��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����
|
| Ksp(AgCl) |
| 1.8��10-10 |
| 1.0��10-16 | ||
|
| 1 | ||
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����391.6 kJ/mol |
| B��1174.7kJ/mol |
| C����700.2kJ/mol |
| D����541.4kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ú���Եõ����顢���Ͱ�����Ҫ����ԭ�� |
| B����֬���Ҵ��������������Ӫ������ |
| C����ά�ء����ǡ������Ǻ�֬����һ�������¶��ɷ���ˮ�ⷴӦ |
| D��Ϊ�ƹ����ܵ�ʹ�ã���ҵ�Ͽɲ��õ��ˮ����ȡ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��̫���ܵ�� |
B�� ����ӵ�� |
C�� ̫���ܼ����� |
D�� ȼ��¯ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٣��ڣ��ܣ��ۣ��� |
| B���ۣ��٣��ܣ��ڣ��� |
| C���ݣ��ۣ��ڣ��٣��� |
| D���ۣ��ܣ��ݣ��ڣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
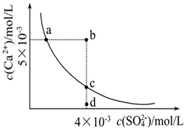 �����£�Ksp��CaSO4��=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ��������ͼ������˵
�����£�Ksp��CaSO4��=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ��������ͼ������˵| A�������£���100mL CaSO4������Һ�У�����400mL 0.01mol/LNa2SO4��Һ����Һ���������� |
| B��b�㽫�г������ɣ�ƽ�����Һ��c��SO42-��һ������3��10-3mol/L |
| C��d����Һͨ���������Ա䵽c�� |
| D��a���Ӧ��Ksp����c���Ӧ��Ksp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | ҩƷ1 | ҩƷ2 | ʵ������ |
| �� | 0.1mol/LNaOH��Һ | 0.1mol/LMgCl2��Һ | ���ɰ�ɫ���� |
| �� | 0.1mol/L��ˮ | 0.1mol/LMgCl2��Һ | ������ |
| �� | 1mol/L��ˮ | 1mol/LMgCl2��Һ | ����� |
| �� | 1mol/L��ˮ | 0.1mol/LMgCl2��Һ | ���ɰ�ɫ���� |
| �� | 0.1mol/L��ˮ | 1mol/LMgCl2��Һ | ������ |
| A��ʵ��������������ɰ�ɫ������˵������c��Mg2+�����������ɳ����ķ����ƶ�������ˮ��Һ��Ũ�Ȳ��������ɳ����ķ����ƶ� |
| B��ʵ�����������Ϊ�Ȼ�þ��Һ�Ͱ�ˮŨ�ȶ����������Ȼ��Ũ������������þ�����ܽ����Ȼ����Һ�� |
| C������������þ�����ܽ����Ȼ����Һ�У����Ȼ�þ��Һ�Ͱ�ˮ��Ӧ���������Ȼ�泥����Ը�������Һ��Ϻ���ܻ���������ɳ������ܽ������ |
| D��ʵ�������������ɰ�ɫ��������Ϊ����������Һ������һ�ֵ�Ũ�ȣ�����ʹ���Һ�����ӻ��ﵽ������þ��Ksp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
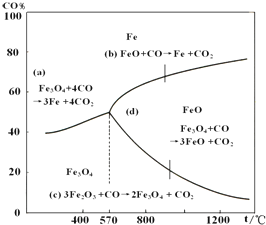 ������ҵ���ҹ������д���ʮ����Ҫ��λ�ã���ҵ�ϲ��ø�¯���������ó�����̿���������ۼ���ʯ��ʯ����ԭ�ϣ���֪������ԭ����ԭ�����еģ���ԭʱ�¶ȼ�CO��CO2ƽ��������CO����������Ĺ�ϵ��ͼ��
������ҵ���ҹ������д���ʮ����Ҫ��λ�ã���ҵ�ϲ��ø�¯���������ó�����̿���������ۼ���ʯ��ʯ����ԭ�ϣ���֪������ԭ����ԭ�����еģ���ԭʱ�¶ȼ�CO��CO2ƽ��������CO����������Ĺ�ϵ��ͼ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com