
【题目】下表是元素周期表的一部分,回答相关的问题。

(1)写出④的元素符号__。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:__。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是__(填相应化学式,下同),碱性最强的是__。
(4)这些元素中(除⑨外),原子半径最小的是__(填元素符号,下同),原子半径最大的是__。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)__。
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式__。
【答案】Mg 2Na+2H2O=2Na++2OH-+H2↑ HClO4 NaOH F Na 2F2+2OH-=OF2+2F-+H2O 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+
【解析】
根据元素在元素周期表正的位置可以得出,①为N元素,②为F元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥Si元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,据此分析。
(1)④为Mg元素,则④的元素符号为Mg;
(2)这些元素中最活泼的金属元素为Na,Na与水发生的反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
(3)这些元素中非金属性最强的是Cl元素,则最高价氧化物对应的水化物为HClO4,这些元素中金属性最强的元素是Na元素,则最高价氧化物对应的水化物为NaOH;
(4)根据元素半径大小比较规律,同一周期原子半径随原子序数的增大而减小,同一主族原子半径随原子序数的增大而增大,可以做得出,原子半径最小的是F元素,原子半径最大的是Na元素;
(5)F2与NaOH反应生成OF2,离子方程式为2F2+2OH-=OF2+2F-+H2O;
(6)⑦为S元素,⑦的低价氧化物为SO2,SO2在Ba(NO3)2溶液中发生氧化还原反应,SO2变成SO42-,NO3-变成NO,方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】过渡金属配合物的一些特有性质的研究正受到许多研究人员的关注,因为这方面的研究无论是理论上还是工业应用上都有重要意义。
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

(1)此配离子中含有的作用力有__________ (填序号)。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)此配合物中碳原子的杂化轨道类型有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu+在酸性条件下能发生下列反应:Cu+![]() Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
A. 该反应显示硫酸具有酸性
B. NH4CuSO3中铜元素全部被氧化
C. 刺激性气味的气体是氨气
D. 反应中硫酸作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯和苯都是重要的化工原料,请回答下列问题。
(1)甲烷的电子式为__________,写出在光照条件下,甲烷与氯气发生反应生成气态有机物的化学方程式:________。
(2)下列叙述不正确的是________
A. CH4与C4H10互为同系物 B. C5H12有3种同分异构体
C. 烷烃的卤代反应很难得到纯净物 D. 烷烃分子中,相邻的三个碳原子可能在同一条直线
(3) 下列物质不可能是乙烯加成产物的是(__________)
A. CH3CH3 B. CH3CHCl2 C. CH3CH2OH D. CH3CH2Br
(4)若将乙烯通入到紫色高锰酸钾溶液中,可以观察到__________,乙烯发生的反应类型为________。
(5) 苯的结构简式:________,它与液溴在催化剂作用下发生取代反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:

(1)反应的△H_______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为_________molL-1s-1,反应的平衡常数K1为____________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T _______100℃(填“大于”“小于”)
②列式计算温度T时反应的平衡常数K2_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
请回答:
①a=_______________;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________。
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是国际化学元素周期表年。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列;准确的预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。

下列说法不正确的是
A.元素甲的原子序数为31
B.元素乙的简单气态氢化物的沸点和稳定性都低于CH4
C.原子半径比较:甲>乙>Si
D.乙的单质可以作为光电转换材料用于太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
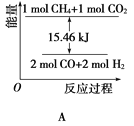



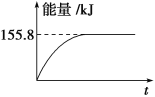
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com