
| A、易形成一价离子 |
| B、从上到下单质的氧化性逐渐减弱 |
| C、从上到下氢化物的沸点逐渐升高 |
| D、从上到下氢化物的稳定逐渐减弱 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、Al3+、AlO2-、NO3-、Cl- |
| B、CrO42-、H+、K+、NO3- |
| C、Ba2+、Na+、HCO3-、OH- |
| D、K+、SO42-、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
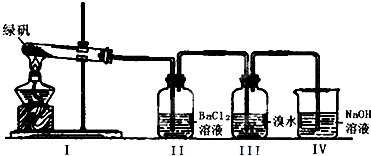
| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体与试管中,加入一定量水溶解. | \ |
| 步骤二: |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行) |
| B、分散系分为:溶液、胶体、浊液(标准:分散质粒子的大小) |
| C、化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化) |
| D、化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Ba2+、Cl-、NO3- |
| B、K+、Na+、Br-、S2- |
| C、H+、Fe3+、I-、NO3- |
| D、Na+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
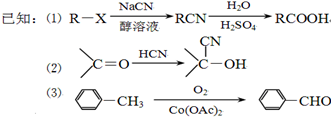
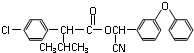 ):
):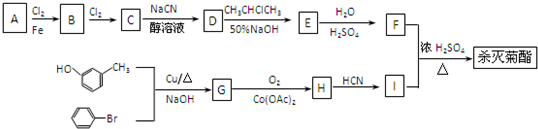
| H2O |
| H2SO4 |
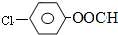 结构,则符合此条件的F共有
结构,则符合此条件的F共有查看答案和解析>>
科目:高中化学 来源: 题型:
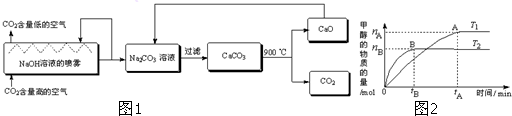
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com