
【题目】2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
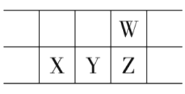
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
【答案】D
【解析】
除了氧元素和氟元素外,其他主族元素的最高正价即主族序数,设W的族序数为x,根据元素周期表中W与X的相对位置可知,X的族序数为x-2,则有x+x-2=8,故x=5,即W为VA族元素,根据元素周期表中各元素的相对位置,可知X为Al,Y为Si,Z为P,W为N。
A.由分析可知,X为Al,W为N,根据元素周期律可知,原子半径:Al>P>N,所以原子半径:W<X,故A正确;
B.氮的非金属性比磷强,所以氮的气态氢化物比磷的气态氢化物热稳定性强,故B正确;
C.Y为Si,硅单质是很好的半导体材料,故C正确;
D.X为铝,铝的最高价氧化物的水化物是氢氧化铝,具有两性,不是强碱,故D错误;
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
A. 加MgCl2B. 加H2OC. 加NaOHD. 加HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
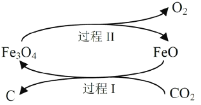
①碳在元素周期表中的位置是_______________。
②整个过程中FeO的作用是__________________。
③写出CO2转化为炭黑的总反应化学方程式__________________。
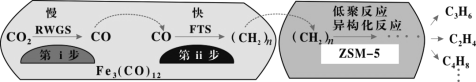
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
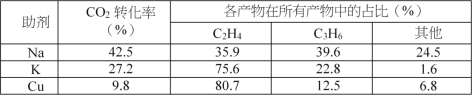
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
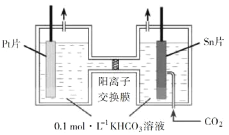
①写出阴极CO2还原为HCOO的电极反应式:________________________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿佐昔芬F主要用于防治骨质疏松症等。其合成路线如下:
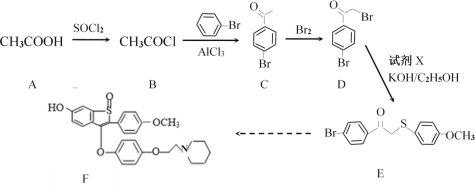
请按要求回答下列问题:
(1)A中最多共平面的原子数目:______;C中所含官能团名称:_______;C→D的反应类型______________。
(2)已知卤原子直接与苯环相连时碳卤键非常牢固,很难断键。写出D与NaOH水溶液加热条件下反应的化学方程式:________________________________________。
(3)试剂X的分子式为C7H8OS,写出X的结构简式:___________________。
(4)C的一种同分异构体M同时满足下列条件的所有可能的结构有(考虑顺反异构现象)_________种。
a.苯环上有两个取代基
b.能与FeCl3溶液发生显色反应
c.能使溴的四氯化碳溶液褪色
写出其中有4种不同化学环境氢原子的结构简式:_______________________。
(5)请写出以1-丙醇和氯苯为原料经四步制备 ![]() 的合成路线(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。________。
的合成路线(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. SiO2晶体为空间网状结构,由共价键形成的原子环中,最小的环上有12个原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
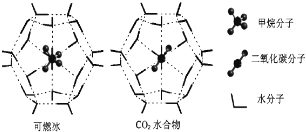
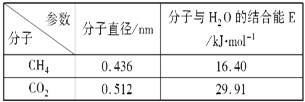
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为_____________。
(3)苯胺![]() )的晶体类型是__________。苯胺与甲苯(
)的晶体类型是__________。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
(4)NH4H2PO4中,电负性最高的元素是______;P的_______杂化轨道与O的2p轨道形成_______键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为____________(用n代表P原子数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com