
某温度下向硫酸镁饱和溶液
(此时溶液中[ ]
A.3 B.5 C.7 D.10
科目:高中化学 来源: 题型:
 二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:
二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是常用的化工原料,工业上常用它来制取硫酸。反应之一是:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6KJ/mol ,回答下面的问题:
2SO3(g) △H=-196.6KJ/mol ,回答下面的问题:
(1) 反应在恒温、恒压下的容积可变的密闭容器中进行,若开始时放入1 mol O2 和2 mol SO2 ,到达平衡时生成1.2 mol SO3 ,则平衡时SO2 的转化率为 ;若再向容器中放入2 mol O2 和4 mol SO2 ,到达平衡后生成的SO3物质的量为 mol。
(2) 某温度下向体积为8L的密闭容器中通入SO2和O2发生反应,上述反应过程中SO2、O2、SO3物质的量变化如下图所示,回答下列问题: ①反应处于平衡状态的时间段是_______ _ 、 。
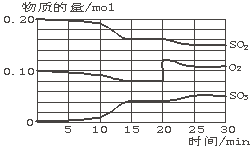
②该温度下此反应的平衡常数是 。 ③反应进行至20 min时,曲线发生变化的原因可能是_________________(用文字表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com