
”¾ĢāÄæ”æĮņĖįŃĒĢśļ§(NH4)aFeb(SO4)c”¤dH2OÓÖ³ĘÄŖ¶ūŃĪ£¬ŹĒĒ³ĀĢÉ«¾§Ģ壬ÓĆĮņĢśæó£ØÖ÷ŅŖŗ¬FeS2”¢SiO2µČ£©ÖʱøÄŖ¶ūŃĪµÄĮ÷³ĢČēĻĀ£ŗ
ŅŃÖŖ£ŗ”°»¹Ō”±Ź±£¬FeS2ÓėH2SO4²»·“Ó¦£¬Fe3+Ķعż·“Ó¦¢ń”¢¢ņ±»»¹Ō£¬·“Ó¦¢ńČēĻĀ£ŗ
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
£Ø1£©Š“³ö”°»¹Ō”±Ź±Fe3+ÓėFeS2·¢Éś»¹Ō·“Ó¦¢ņµÄĄė×Ó·½³ĢŹ½£ŗ__________________________”£ŹµŃéŹŅ¼ģŃé”°»¹Ō”±ŅŃĶźČ«µÄ·½·ØŹĒ£ŗ__________________________”£
£Ø2£©³ĘČ”11.76gŠĀÖĘÄŖ¶ūŃĪ£¬ČÜÓŚĖ®Åä³É250mLČÜŅŗ”£Č”25.00mLøĆČÜŅŗ¼ÓČė×ćĮæµÄBaCl2ČÜŅŗ£¬µĆµ½°×É«³Įµķ1.398g£»ĮķČ”25.00mLøĆČÜŅŗÓĆ0.0200mol/LKMnO4ĖįŠŌČÜŅŗµĪ¶Ø£¬µ±MnO4-Ē”ŗĆĶźČ«±»»¹ŌĪŖMn2+Ź±£¬ĻūŗÄČÜŅŗµÄĢå»żĪŖ30.00mL”£ŹŌČ·¶ØÄŖ¶ūŃĪµÄ»ÆѧŹ½£ØĒėŠ“³ö¼ĘĖć¹ż³Ģ£©_________”£
”¾“š°ø”æ FeS2+2Fe3+=3Fe2++2S”ż ȔɣĮæĖį½žŗóµÄČÜŅŗ£¬ĻņĘäÖŠµĪ¼ÓŹżµĪKSCNČÜŅŗ£¬Čē¹ūČÜŅŗ±äŗģŌņ”°»¹Ō”±Ī“ĶźČ«£¬·“Ö®£¬ŅŃĶźČ«”£ Ōѳʷ֊µÄn(SO42-)£½10”Į1.398g”Ā233g/mol£½0.06mol
n(MnO4-)£½0.0200mol/L”Į0.03L£½0.0006 mol
ÓɵƏ§µē×ÓŹŲŗćæÉÖŖ£ŗn(Fe2+)£½5 n(MnO4-)=0.003mol Ōѳʷ֊n(Fe2+)=0.03 mol
ÓɵēŗÉŹŲŗćæÉÖŖ£ŗŌѳʷ֊n(NH4+)=0. 06mol
ÓÉÖŹĮæŹŲŗć£ŗn(H2O)=0.18 mol
¹Ź»ÆѧŹ½ĪŖ£ŗ(NH4)2Fe(SO4)26H2O»ņ(NH4)2SO4FeSO46H2O
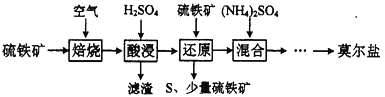
”¾½āĪö”æĮņĢśæó(Ö÷ŅŖŗ¬FeS2”¢SiO2µČ)ŌŚæÕĘųÖŠ±ŗÉÕ£¬µĆ¶žŃõ»ÆĮņĘųĢåŗĶŃõ»ÆĢś”¢¶žŃõ»Æ¹čµČ¹ĢĢ壬¼ÓĮņĖįČܽā£¬¹żĀĖ³żČ„¶žŃõ»Æ¹č£¬µĆĮņĖįĢśČÜŅŗ£¬ĮņĖįĢśČÜŅŗÖŠŌŁ¼ÓČėĮņĢśæó£¬FeS2°ŃĢśĄė×Ó»¹ŌĪŖFe2+£¬Ķ¬Ź±Éś³ÉS³Įµķ£¬¹żĀĖ£¬ĀĖŌüŗ¬ÓŠS”¢ĮņĢśæó£¬ĀĖŅŗÖŠÖ÷ŅŖŗ¬ÓŠĮņĖįŃĒĢśµÄ»ģŗĻČÜŅŗ£¬Ļņ»ģŗĻČÜŅŗÖŠ¼ÓČėĮņĖįļ§£¬¾¹żÕō·¢ÅØĖõ½µĪĀ½į¾§£¬¹żĀĖ£¬Ļ“µÓ£¬øÉŌļæɵĆÄŖ¶ūŃĪ”£
(1)øł¾ŻÉĻĆęµÄ·ÖĪöæÉÖŖ£¬”°»¹Ō”±Ź±£¬ĢśĄė×Ó×öŃõ»Æ¼Į£¬Čē¹ūpH¹żøߏ±ĢśŌŖĖŲ½«³Įµķµ¼ÖĀ²śĀŹ½µµĶ£¬”°»¹Ō”±Ź±FeS2°ŃĢśĄė×Ó»¹ŌĪŖFe2+£¬Ķ¬Ź±Éś³ÉS³Įµķ£¬ĖłŅŌ·“Ó¦¢ņµÄĄė×Ó·½³ĢŹ½ĪŖFeS2+2Fe3+=3Fe2++2S”ż£¬ŹµŃéŹŅ¼ģŃé”°»¹Ō”±ŅŃĶźČ«µÄ·½·ØŹĒȔɣĮæĖį½žŗóµÄČÜŅŗ£¬ĻņĘäÖŠµĪ¼ÓŹżµĪKSCNČÜŅŗ£¬Čē¹ūČÜŅŗ±äŗģŌņ”°»¹Ō”±Ī“ĶźČ«£¬·“Ö®£¬ŅŃĶźČ«£¬¹Ź“š°øĪŖ£ŗFeS2+2Fe3+=3Fe2++2S”ż£» ȔɣĮæĖį½žŗóµÄČÜŅŗ£¬ĻņĘäÖŠµĪ¼ÓŹżµĪKSCNČÜŅŗ£¬Čē¹ūČÜŅŗ±äŗģŌņ”°»¹Ō”±Ī“ĶźČ«£¬·“Ö®£¬ŅŃĶźČ«£»
(2)³ĘČ”11.76gŠĀÖĘÄŖ¶ūŃĪ£¬ČÜÓŚĖ®Åä³É250mLČÜŅŗ£¬Č”25.00mLøĆČÜŅŗ£¬¼ÓČė×ćĮæµÄBaCl2ČÜŅŗ£¬µĆµ½°×É«³ĮµķĮņĖį±µµÄÖŹĮæĪŖ1.398g£¬ĘäĪļÖŹµÄĮæĪŖ![]() =0.006mol£¬ĖłŅŌn(SO42-)=0.006mol£¬ĮķČ”25.00mLøĆČÜŅŗÓĆ0.0200mol/L KMnO4ĖįŠŌČÜŅŗµĪ¶Ø£¬µ±MnO4-Ē”ŗĆĶźČ«±»»¹ŌĪŖMn2+Ź±£¬ĻūŗÄČÜŅŗµÄĢå»żĪŖ30.00mL£¬øł¾ŻĢāŅā£¬
=0.006mol£¬ĖłŅŌn(SO42-)=0.006mol£¬ĮķČ”25.00mLøĆČÜŅŗÓĆ0.0200mol/L KMnO4ĖįŠŌČÜŅŗµĪ¶Ø£¬µ±MnO4-Ē”ŗĆĶźČ«±»»¹ŌĪŖMn2+Ź±£¬ĻūŗÄČÜŅŗµÄĢå»żĪŖ30.00mL£¬øł¾ŻĢāŅā£¬
5Fe2+ + MnO42-+8H+=5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.02000molL-1”Į0.03L£¬
ĖłŅŌn(Fe2+)=0.003mol£¬øł¾ŻµēŗÉŹŲŗć£ŗn(NH4+)+2n(Fe2+)=2n(SO42-)£¬n(NH4+)=0.006mol£»250mLČÜŅŗÖŠn(SO42-)=0.06mol£¬n(Fe2+)=0.03mol£¬n(NH4+)=0.06mol£¬n(H2O)= ![]() =0.18 mol£¬ĖłŅŌn(SO42-)£ŗn(Fe2+)£ŗn(NH4+)£ŗn(H2O)=0 06 mol£ŗ0 03 mol£ŗ0 06mol£ŗ0 18 mol=2£ŗ1£ŗ2£ŗ6£¬ĖłŅŌÄŖ¶ūŃĪµÄ»ÆѧŹ½ĪŖ(NH4)2Fe(SO4)26H2O[»ņ(NH4)2SO4FeSO46H2O]£¬¹Ź“š°øĪŖ£ŗ(NH4)2Fe(SO4)26H2O[»ņ(NH4)2SO4FeSO46H2O]”£
=0.18 mol£¬ĖłŅŌn(SO42-)£ŗn(Fe2+)£ŗn(NH4+)£ŗn(H2O)=0 06 mol£ŗ0 03 mol£ŗ0 06mol£ŗ0 18 mol=2£ŗ1£ŗ2£ŗ6£¬ĖłŅŌÄŖ¶ūŃĪµÄ»ÆѧŹ½ĪŖ(NH4)2Fe(SO4)26H2O[»ņ(NH4)2SO4FeSO46H2O]£¬¹Ź“š°øĪŖ£ŗ(NH4)2Fe(SO4)26H2O[»ņ(NH4)2SO4FeSO46H2O]”£


 ÓäæģµÄŗ®¼ŁÄĻ¾©³ö°ęÉēĻµĮŠ“š°ø
ÓäæģµÄŗ®¼ŁÄĻ¾©³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢W¾łĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ĖüĆĒŌŚÖÜĘŚ±ķÖŠĻą¶ŌĪ»ÖĆČēĶ¼ĖłŹ¾”£ČōYŌ×ÓµÄ×īĶā²ćµē×ÓŹĒÄŚ²ćµē×ÓŹżµÄ3±¶£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
![]()
A. XµÄĘųĢ¬Ēā»ÆĪļ±ČYµÄĪȶØ
B. WµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌ±ČZµÄĒæ
C. ZµÄ·Ē½šŹōŠŌ±ČYµÄĒæ
D. XÓėYŠĪ³ÉµÄ»ÆŗĻĪļ¶¼Ņ×ČÜÓŚĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµ°°×ÖŹ·¢ÉśµÄĻĀĮŠ¹ż³ĢÖŠ£¬æÉÄęµÄŹĒ£Ø””””£©
A.±äŠŌ
B.ÖóŹģ
C.ŃĪĪö
D.¼ÓČėÅØĮņĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijæĪĶā»ī¶ÆŠ”×éµÄĶ¬Ń§£¬ŌŚŹµŃéŹŅ×öŠæÓėÅØĮņĖį·“Ó¦µÄŹµŃéÖŠ£¬¼×Ķ¬Ń§ČĻĪŖ²śÉśµÄĘųĢåŹĒ¶žŃõ»ÆĮņ£¬¶ųŅŅĶ¬Ń§ČĻĪŖ³ż¶žŃõ»ÆĮņĘųĢåĶā£¬»¹æÉÄܲśÉśĒāĘų”£ĪŖĮĖŃéÖ¤ÄÄĪ»Ķ¬Ń§µÄÅŠ¶ĻÕżČ·£¬±ūĶ¬Ń§Éč¼ĘĮĖČēĶ¼ĖłŹ¾ŹµŃé×°ÖĆ(ŠæÓėÅØĮņĖį¹²ČČŹ±²śÉśµÄĘųĢåĪŖX£¬ĘųĢå·¢Éś×°ÖĆĀŌČ„)”£ŹŌ»Ų“š£ŗ
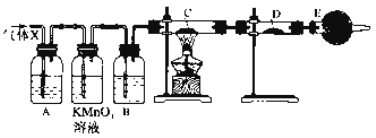
£Ø1£©ÉĻŹö·“Ó¦ÖŠÉś³É¶žŃõ»ÆĮņµÄ»Æѧ·½³ĢŹ½ĪŖ__________________”£
£Ø2£©ŅŅĶ¬Ń§ČĻĪŖ»¹æÉÄܲśÉśĒāĘųµÄĄķÓÉŹĒ__________________”£
£Ø3£©±ūĶ¬Ń§ŌŚ°²×°ŗĆ×°ÖĆŗ󣬱ŲŠėŹ×ĻČ½ųŠŠµÄŅ»²½²Ł×÷ŹĒ£ŗ_________________”£
£Ø4£©AÖŠ¼ÓČėµÄŹŌ¼ĮæÉÄÜŹĒ________£¬×÷ÓĆŹĒ__________________£»
BÖŠ¼ÓČėµÄŹŌ¼ĮæÉÄÜŹĒ________£¬×÷ÓĆŹĒ__________________£»
EÖŠ¼ÓČėµÄŹŌ¼ĮæÉÄÜŹĒ________£¬×÷ÓĆŹĒ____________________”£
£Ø5£©æÉŅŌÖ¤Ć÷ĘųĢåXÖŠŗ¬ÓŠĒāĘųµÄŹµŃéĻÖĻóŹĒ£ŗCÖŠ£ŗ________£¬DÖŠ£ŗ________”£Čē¹ūČ„µō×°ÖĆB£¬»¹ÄÜ·ńøł¾ŻDÖŠµÄĻÖĻóÅŠ¶ĻĘųĢåXÖŠÓŠĒāĘų£æ________(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)£¬ŌŅņŹĒ________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲČČ»Æѧ·½³ĢŹ½¼°Ę䊚ŹöÕżČ·µÄŹĒ
A. ĒāĘųµÄČ¼ÉÕČČĪŖ-285.5 kJ/mol£¬ŌņĖ®µē½āµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2O(l)=2H2(g)+O2(g) ¦¤H=+285.5 kJ/mol
B. lmol¼×ĶéĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶH2O(l)Ź±·Å³ö890kJČČĮ棬ĖüµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g) H2O(l) ”÷H= -445 kJ/mol
CO2(g) H2O(l) ”÷H= -445 kJ/mol
C. ŅŃÖŖC(ŹÆÄ«£¬s)![]() C(½šøÕŹÆ£¬s) ¦¤H=+1.9kJ/mol£¬Ōņ½šøÕŹÆ±ČŹÆÄ«ĪȶØ
C(½šøÕŹÆ£¬s) ¦¤H=+1.9kJ/mol£¬Ōņ½šøÕŹÆ±ČŹÆÄ«ĪȶØ
D. 500”ę”¢30MPaĻĀ£¬½«0.5molN2ŗĶ1.5molH2ÖĆÓŚĆܱյÄČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3(g)£¬·ÅČČ19.3kJ£¬ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ N2(g)+3H2(g)![]() 2NH3(g) ¦¤H=-38.6kJ/mol
2NH3(g) ¦¤H=-38.6kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
A. CӢHӢ 0
B. CӢHӢ 0ӢN
C. CӢHӢ0ӢNӢS
D. CӢHӢ0ӢNӢ P
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25 ”ꏱ£¬ŌŚ”°H2A”ŖHA-”ŖA2-”±µÄĖ®ČÜŅŗĢåĻµÖŠ£¬H2A”¢HA-ŗĶA2- ČżÕßÖŠø÷×ŌĖłÕ¼µÄĪļÖŹµÄĮæ·ÖŹż£Ø¦Į£©ĖęČÜŅŗpH±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
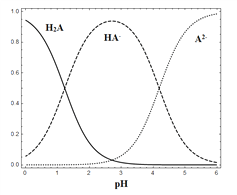
A. ŌŚŗ¬H2A”¢HA-ŗĶA2- µÄČÜŅŗÖŠ£¬¼ÓČėÉŁĮæNaOH¹ĢĢ壬¦Į£ØHA-£©Ņ»¶ØŌö“ó
B. ½«µČĪļÖŹµÄĮæµÄNaHAŗĶNa2A»ģŗĻĪļČÜÓŚĖ®£¬ĖłµĆµÄČÜŅŗÖŠ¦Į£ØHA-£©=¦Į£ØA2-£©
C. NaHAČÜŅŗÖŠ£¬HA-µÄĖ®½āÄÜĮ¦Š”ÓŚHA-µÄµēĄėÄÜĮ¦
D. ŌŚŗ¬H2A”¢HA-ŗĶA2-µÄČÜŅŗÖŠ£¬Čōc(H2A)+2c(A2-)+c(OH-)=c(H+)£¬Ōņ¦Į£ØH2A£©ŗĶ¦Į£ØHA-£©Ņ»¶ØĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĶ¬Ń§ŅūŹ³Ļ°¹ßæĘѧµÄŹĒ£Ø””””£©
A.¶ą³ŌČā£¬ÉŁ³ŌŹß²ĖĖ®¹ū
B.ŗĻĄķÉćČėĢĒĄą”¢ÓĶÖ¬µČ£¬×¢ŅāÉÅŹ³Ę½ŗā
C.ĪŖ·ĄÖ¹±äÅÖ£¬³“²ĖŹ±²»·ÅÓĶ
D.¶ąŅūÓĆ“æ¾»Ė®£¬ÉŁŅūÓĆæóČŖĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø””””£©
A. HÓėOæÉŠĪ³É¼Čŗ¬¼«ŠŌ¹²¼Ū¼üÓÖŗ¬·Ē¼«ŠŌ¹²¼Ū¼üµÄ»ÆŗĻĪļ
B. 28gÓÉ C2H4ŗĶ C3H6×é³ÉµÄ»ģŗĻĪļÖŠ£¬HŌ×ӵďżÄæĪŖ4NA
C. ŌŚD218OÖŠ£¬ÖŹĮæŹżÖ®ŗĶŹĒÖŹ×ÓŹżÖ®ŗĶµÄĮ½±¶
D. 1mol ”ŖCH3ÖŠŗ¬ÓŠµÄµē×ÓŹżĪŖ9NA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com