
| A. | 含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(1)△H=-114.8kJ/mol | |
| B. | 已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol | |
| D. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.31kJ•mol-1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)═H2O(1)+BaSO4(s)△H<-57.31kJ•mol-1 |
分析 A.中和热是稀的强酸和稀的强碱反应生成1mol水的过程所放出的能量;
B.可逆反应中,反应物不可能完全转化成生成物,则生成三氧化硫的物质的量小于2mol;
C.燃烧热为1mol物质燃烧生成最稳定的氧化物所放出的能量,该反应中气态水不如液态水稳定;
D.稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于57.31kJ,结合放热反应的焓变为负值分析.
解答 解:A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4kJ/mol,故A错误;
B.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,由于该反应为可逆反应,在容器中充入2molSO2和1molO2充分反应时,反应物不能全部转化为生成物,所以最终放出的热量小于196.64kJ,故B错误;
C.因燃烧热在某一温度和压强下lmol某物质完全燃烧生成稳定氧化物时所释放出的热量,故应该是生成液态水时放出的热量,所以H2的燃烧热为285.8kJ•mol-1,故C错误;
D.钡离子与硫酸根离子生成硫酸钡的反应为放热反应,导致放出热量增大,则Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)═H2O(1)+BaSO4(s)△H<-57.31kJ•mol-1,故D正确;
故选D.
点评 本题考查了反应热与焓变的综合应用,题目难度中等,明确燃烧热、中和热的概念为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g≤m≤128g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mL 1.5 mol•L-1的AgNO3溶液 | B. | 10mL 2 mol•L-1的NaCl溶液 | ||
| C. | 5mL 1 mol•L-1的AlCl3溶液 | D. | 5mL 1.6mol•L-1的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
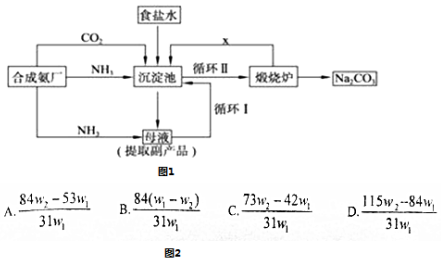
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO32- | |
| B. | 加入Ba(NO3)2 溶液,生成白色沉淀,加入稀盐酸后沉淀不溶解时,可确定有SO42-存在 | |
| C. | 加入CCl4,振荡,静置,下层溶液呈紫色,则原溶液中存在碘单质 | |
| D. | 加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解时,可确定有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )
某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 浓氨水 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
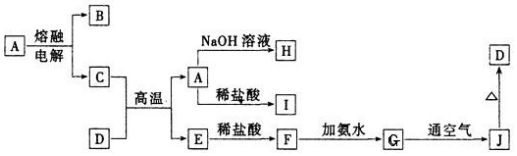
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com