
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
| ||
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
| ||
| ||
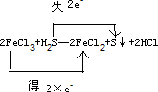 ,
,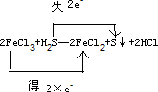 ;FeCl3;H2S;S;FeCl2;2Fe3++H2S=2Fe2++S↓+2H+;
;FeCl3;H2S;S;FeCl2;2Fe3++H2S=2Fe2++S↓+2H+;
| ||
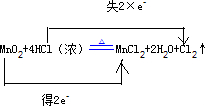 ,
,
| ||
 ;MnO2;HCl;Cl2;MnCl2;MnO2+4H ++2Cl-
;MnO2;HCl;Cl2;MnCl2;MnO2+4H ++2Cl-
| ||


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| 液氨 |
| C2H5OC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 | 充电 |

查看答案和解析>>
科目:高中化学 来源:山东省潍坊市三县2011-2012学年高二上学期模块学分认定检测化学试题 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市高三上学期期末检测理综化学试卷(解析版) 题型:推断题
以下由A→G的合成路线叫做“Krohnke反应”:

A物质中与苯环相连的“-CH2X”叫做“苄基”。
请回答下列问题:
(1)物质A在酸性KMnO4溶液中两个侧链均可被氧化,其有机产物的名称叫做____;把A与NaOH水溶液共热,所得到的有机产物的结构简式为__________;
(2)反应②产物中D物质的化学式为____;用足量的H2还原吡啶,所得的产物的结构简式为___________________;
(3)物质G与银氨溶液反应的化学方程式为____________ ___________。
(4)物质A与烧碱溶液共热的反应类型属于__ __反应,产物B的水溶性为__________(填“可溶于水”或“不溶于水”);
(5)对比问题(1)的两个反应,“Krohnke反应”在有机合成中的作用是 __。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学电池在通讯、交通及日常生活中有着广泛的应用。
⑴下列相关说法正确的是
A.通过某种电池单位质量或单位体积所能输出能量的多少,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、甲烷、乙烷、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
⑵目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
2Ni(OH)2+Cd(OH)2 Cd+2NiO(OH)+2H2O
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,下列说法正确的是:
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd作负极 D.该电池是一种二次电池
⑶在宇宙飞船和其它航天器上经常使用的氢氧燃料电池是一种新型电池,其结构如图所示:a、b两个电极均由多孔的炭块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
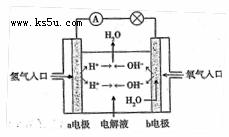
①a电极是电源的 极
②若该电池为飞行员提供了36Kg的水,则电路中通过了 mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com