
【题目】下列各种糖类物质中,既存在于动物细胞内又存在于植物细胞内的是
A. 淀粉和核糖 B. 葡萄糖、核糖和麦芽糖
C. 核糖、脱氧核糖和葡萄糖 D. 糖原、乳糖、蔗糖
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池, 电池原理如右图所示,则下列有关说法正确的是
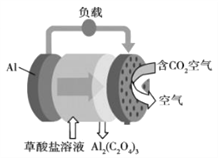
A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42- -2e- ![]() 2CO2
2CO2
C. 每生成1mol Al2(C2O4)3,有6mol电子流过负载
D. 随着反应进行,草酸盐浓度不断变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯的说法,其中错误的是( )
A.乙烯分子的双键中有一键较易断裂
B.烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120°
C.乙烯的化学性质比乙烷活泼
D.乙烯和环丙烷 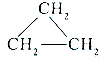 的分子组成符合通式CnH2n , 因此它们属于同系物
的分子组成符合通式CnH2n , 因此它们属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)氨的催化氧化反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
第0 min | 0.8 | 1.6 | 0 |
第1 min | a | 1.35 | 0.2 |
第2 min | 0.3 | 0.975 | 0.5 |
第3 min | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应在第1min到第2min时,NH3的平均反应速率为______________。
②反应在第3 min时改变了条件,改变的条件可能是___________(填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
A.单位时间内生成n mol NO的同时生成n mol NH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
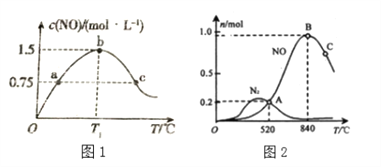
(2)若在容积为2L的密闭容器中充入4.0molNH3(g)和5.0molO2(g),发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
(3)氨催化氧化时会发生两个竞争反应,分别为
反应I:4NH![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如上图2:
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②C点比B点所产生的NO的物质的量少的主要原因______________________________。(4)通过以上两个竞争反应写出NO分解生成N2与O2的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“钿”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A. Ts是第七周期第VIIA族元素
B. Ts的同位素原子具有相同的电子数
C. 中子数为176的Ts核素符号是![]()
D. Ts在同族元素中非金属性最弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g) ![]() 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是 ( )
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是 ( )
A.SO2完全转化为SO3 B.各物质浓度均不再改变
C.SO2和SO3的浓度一定相等 D.正、逆反应速率相等且等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质]
A、B、C、D为元素周期表中前四周期的四种元素,且原子序数依次增大,C、D同周期,且A、B、C均不在同一周期,其中A与D同主族,且该主族中有三种非金属元素,B为非金属元素且原子最外层有3对成对电子,C元素位于元素周期表第10列。请回答下列问题:
(1)C元素的原子序数为________,基态D原子的简化电子排布式为________。
(2)与A同一周期的所有主族元素中第一电离能小于A的元素共有_______种。
(3) D元素可形成DX3的卤化物,性质和结构与AX3类似(X表示卤素元素),在水溶液中强烈水解,请写出DCl3与水反应的化学方程式:____________。
(4) 如图为D2B3的分子结构图,B杂化方式为____________。

(5) 试比较A、B形成的简单氢化物的熔沸点的高低并解释:________ (简单氢化物用分子式表示)。
(6) 研究晶体结构的最常用方法是________;如图为一种含C和D两种元索的品体的晶胞图,呈六方结构,晶胞参数为底面边长为anm、高为bmm。
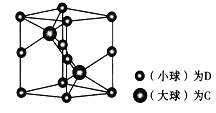
①该晶胞组成物质的化学式为__________。
②已知D和C的相对原子质量分别为M1和M2,若晶体密度为ρg/cm3,NA表示阿伏加德罗常数,用合理表达式表示该晶体的密度为________g/cm3 (列出计算式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽然很少,但在维持正常生命活动中是不可缺少的。可通过哪一实例得到证明
A. 缺镁时叶片变黄 B. 油菜缺硼时只开花不结果
C. 动物血液中钙盐含量太低会抽搐 D. 缺磷时会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是______________
(2)C、B可按原子个数比1:1形成离子化合物乙的电子式___________
(3)C、D、E三种元素的离子半径由小到大的顺序是____________(用元素符号填写)。
(4)E单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:____________________
(5)简述比较D与E金属性强弱的实验方法:_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com