
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
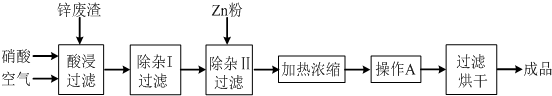
分析 生产Zn(NO3)2•6H2O晶体,其工艺流程为:冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),加入硝酸通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+(少量)、Cu2+、Al3+,在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,调节溶液PH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,加热蒸发,浓缩结晶,过滤洗涤得到ZnSO4•6H2O晶体;
(1)从温度、浓度、增大接触面积等分析增大反应速率;
(2)在过滤器上洗涤沉淀,使蒸馏水浸没沉淀,水自然流下;
(3)H2O2与Fe2+发生氧化还原反应生成铁离子;根据沉淀和pH表分析控制溶液的pH;调节溶液PH是和盐溶液中氢离子反应促进水解正向进行;利用铁离子与KSCN反应出现血红色来检验铁离子是否存在;
(4)Zn与溶液中铜离子反应,冷却结晶得到Zn(NO3)2•6H2O晶体.
解答 解:(1)因适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率,所以在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取上述措施,
故答案为:适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等);
(2)在过滤器上洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次,
故答案为:沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次;
(3)“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4,调节pH所用X应和溶液中氢离子发生反应促进水解平衡正向进行生成氢氧化物沉淀,硫酸和硝酸不能调节溶液PH增大且引入杂质,故选AB,又铁离子与KSCN反应出现血红色,则静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;5.2~5.4;AB;静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全;
(4)由流程图及离子沉淀的pH,则加入Zn粉的作用除去溶液中的Cu2+,除杂后的溶液加热浓缩后、冷却结晶得到晶体,
故答案为:除去溶液中的Cu2+;冷却结晶.
点评 本题考查晶体的制备及混合物的分离、提纯,注意已知信息与所学知识的结合来分析解答问题,除杂流程及表格数据是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 物质 | Sb2S3 | PbS | FeS | PbCl2 | PbCO3 |
| Ksp | 2×10?93 | 1×10?28 | 6×10?18 | 1.6×10?5 | 7.4×10?14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
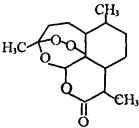 2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素能与碳酸氢钠溶液反应生成二氧化碳 | |
| B. | 青蒿素分子有7个手性碳原子 | |
| C. | 青蒿素在一定条件下能与NaOH溶液反应 | |
| D. | 青蒿素是脂溶性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 化学键断裂的变化一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
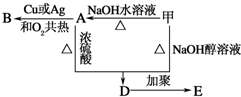
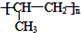 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子有1个δ键,1个π键 | |
| B. | 乙烯分子中2个碳原子都是sp3杂化 | |
| C. | 乙烯分子存在非极性键 | |
| D. | 乙烯分子中所有原子都在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
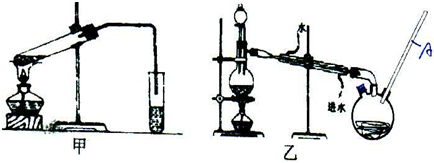
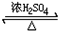 HCOOCH3+H2O
HCOOCH3+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com