
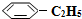 )可生产塑料单体苯乙烯(
)可生产塑料单体苯乙烯(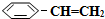 ),其原理反应是:
),其原理反应是: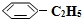 (g)?
(g)?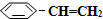 (g)+H2(g)△H=+125kJ•mol-1.
(g)+H2(g)△H=+125kJ•mol-1.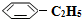 (g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
n(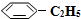 )/mol )/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(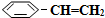 )/mol )/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
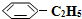 (g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动
(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动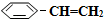 (g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下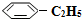 (g)和
(g)和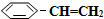 (g)的浓度c随时间t变化的曲线.
(g)的浓度c随时间t变化的曲线.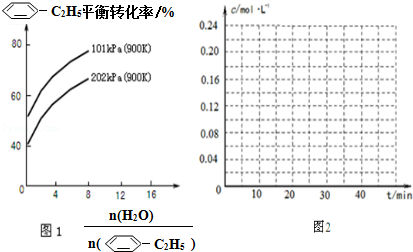
分析 (1)20min时参加反应的苯乙烷为0.4mol-0.26mol=0.14mol,而△n(苯乙烯)=△n(乙苯);
(2)体系总压强不变时,加入水蒸气稀释,反应体系的分压减小,故平衡向气体体积增大的方向移动;
(3)与原平衡为完全等效平衡,则苯乙烯、氢气的起始物质的量为0.4mol,起始浓度为0.2mol/L,平衡时,随反应进行苯乙烯浓度减小、乙苯浓度增大,40min到达平衡时,苯乙烯为$\frac{0.16mol}{2L}$=0.08mol/L,乙苯浓度为$\frac{(0.4-0.16)mol}{2L}$=0.12mol/L.
解答 解:(1)20min时参加反应的苯乙烷为0.4mol-0.26mol=0.14mol,而△n(苯乙烯)=△n(乙苯)=0.15mol,
故答案为:0.14;
(2)体系总压强不变时,加入水蒸气稀释,反应体系的分压减小,故平衡向气体体积增大的方向移动,乙苯的平衡转化率将越大,
故答案为:越大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)与原平衡为完全等效平衡,则苯乙烯、氢气的起始物质的量为0.4mol,起始浓度为0.2mol/L,平衡时,随反应进行苯乙烯浓度减小、乙苯浓度增大,40min到达平衡时,苯乙烯为$\frac{0.16mol}{2L}$=0.08mol/L,乙苯浓度为$\frac{(0.4-0.16)mol}{2L}$=0.12mol/L,乙苯、苯乙烯的浓度c随时间t变化的曲线为: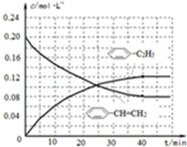 ,
,
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、化学平衡图象等问题,题目难度中等,(2)为易错点为,注意水蒸气产生的分压对化学平衡的影响.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:填空题
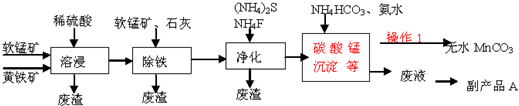
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3?↑+CO32-+2H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证二氧化硫漂白性 | 二氧化硫通入溴水中,看溶液颜色是否褪色 |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加氢氧化钠溶液 |
| C | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| D | 验证Ksp(AgI)>Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com