
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
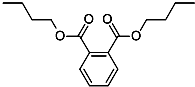 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸( )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )| A. | 邻苯二甲酸二丁酯(DBP)分子式为:C16H22O4 | |
| B. | 邻苯二甲酸二丁酯(DBP)苯环上的一氯代物有4种 | |
| C. | 邻苯二甲酸二丁酯(DBP)属于乙酸乙酯的同系物 | |
| D. | 丁醇有4种不同结构,所以戊醛也有4种不同结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 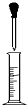 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 | |
| B. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| C. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 热化学方程式中,如果没有注明温度和压强,表示反应热是在25℃,101KPa测得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠投入FeSO4溶液中,可以得到单质铁 | |
| B. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| C. | Na2O与Na2O2中阴阳离子的个数比均为1:2 | |
| D. | 在2Na2O2+2H2O=4NaOH+O2反应中,每生成1molO2,消耗2mol氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
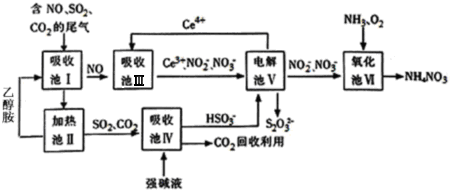
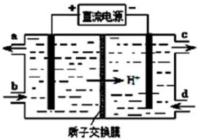
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
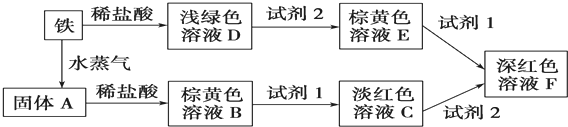
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com