
| A. | 0.2 mol•L-1的NaHCO3溶液中:c (Na+ )>c(HCO3-)>c (OH-)>c (H+ ) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c (Na+ )>c(N3-)>c (OH-)>c (H+ ) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c (NaClO)>c (NaHCO3)>c (CH3COONa) |
分析 A.0.2 mol•L-1的NaHCO3溶液中碳酸氢根离子水解程度大于其电离程度;
B.因醋酸为弱酸,所以NaN3为强碱弱酸盐,N3?会发生水解;
C.溶液的pH=7溶液呈中性,结合电荷守恒分析判断;
D.碳酸氢钠、醋酸钠次氯酸钠是盐,盐溶液的碱性强弱取决于阴离子的水解能力,当pH相同时,越难水解的盐,其浓度越大.
解答 解:A..0.2 mol•L-1的NaHCO3溶液中碳酸氢根离子水解程度大于其电离程度,溶液显碱性,c (Na+ )>c(HCO3-)>c (OH-)>c (H+ ),故A正确;
B.NaN3为强碱弱酸盐,N3?会发生水解显碱性,故NaN3水溶液中离子浓度大小顺序为,c(Na+)>c(N3?)>c(OH?)>c(H+),故B正确;
C.常温下向氨水中逐滴滴入盐酸至溶液的pH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(H+)+c(NH4+),则混合液中c(NH4+)=c(Cl-),故C正确;
D.常温下,酸性醋酸>碳酸>次氯酸,水解程度:次氯酸根离子>碳酸氢根离子>醋酸根离子,等pH的CH3COONa、NaHCO3、NaClO三种溶液中,溶液中溶质的浓度大小关系为c (NaClO)>c (NaHCO3)>c (CH3COONa),故D正确;
故选D.
点评 本题考查了盐类水解原理、溶液中离子浓度大小比较、电解质溶液中电荷守恒等,注意水解程度的比较,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 钠和冷水反应:Na+2H2O=Na++OH-+H2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 氢氧化钡溶液与稀硫酸反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | 铁溶于稀硫酸:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )
某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )| A. | 浓HNO3、P4(白磷) | B. | 乙醇、汞液 | ||
| C. | 氯水、KClO3 | D. | 双氧水、“84”消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
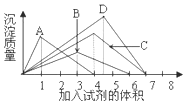
| A. | 往AlCl3溶液中逐滴加入NaOH溶液 | B. | 往澄清石灰水中逐渐通入CO2气体 | ||
| C. | 往FeCl3溶液中逐滴加入NaOH溶液 | D. | 往NaAlO2溶液中滴加入盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2CO3 | |
| D. | (NH4)2SO4 NH4Cl NaNO3 Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com