
| A. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| B. | R的气态氢化物的水溶液具有强酸性 | |
| C. | R是金属元素 | |
| D. | R的气态氧化物不能在氧气中燃烧 |
分析 第三周期元素R,有3个电子层,次外层和最内层的电子数之差为8-2=6,它的原子核外最外层实现8电子稳定结构所需的电子数小于6,且等于最内层电子数的整数倍,则R元素原子核外最外层实现8电子稳定结构所需的电子数为2或4,若为2,则R为硫元素,符合题意;若为4,则R为硅元素,符合题意.结合元素化合物性质判断.
解答 解:第三周期元素R,有3个电子层,次外层和最内层的电子数之差为8-2=6,它的原子核外最外层实现8电子稳定结构所需的电子数小于6,且等于最内层电子数的整数倍,则R元素原子核外最外层实现8电子稳定结构所需的电子数为2或4,若为2,则R为硫元素,符合题意;若为4,则R为硅元素,符合题意.
A、S、Si的氧化物为SO2、SO3、SiO2,都是酸性氧化物,故A正确;
B、Si元素的氢化物的化学式为SiH4,难溶于水没有强酸性,故B错误;
C、R为S或Si元素,属于非金属元素,故C错误;
D、若R为Si元素,则Si没有气态氧化物,故D错误.
故选:A.
点评 本题以元素推断为载体,考查原子结构位置与性质关系、元素化合物知识,题目难度不大,推断元素是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 食盐和醋都是常用的食品添加剂 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | ClO2、O3等均可用于饮用水消毒 | |
| D. | 静脉滴注NaHCO3溶液可治疗水杨酸中毒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到稳定结构.
H2O和CS2分子中的原子都达到稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
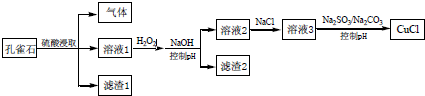
| A. | H2O2 将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去 | |
| B. | CO32-作用是控制溶液pH,促使CuCl 沉淀的生成 | |
| C. | SO32-将溶液3 中的Cu2+还原,反应得到CuCl | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量$\frac{S{O}_{3}^{2-}}{C{O}_{3}^{2-}}$的溶液中,同样可制取CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z |
| A. | Y的最高价氧化物对应水化物的酸性比Z的弱 | |
| B. | Y的气态氢化物的稳定性较Z的强 | |
| C. | 非金属性:X>Y>Z | |
| D. | 原子半径:Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com