
| A. | 原混合气体的体积为1.1VL | |
| B. | 原混合气体的体积为1.2VL | |
| C. | 反应达到限度时,气体A消耗掉0.05 VL | |
| D. | 反应达到限度时,气体B消耗掉0.05 VL |
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:实验题
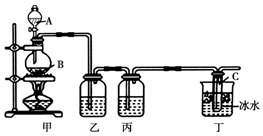 某化学活动小组欲用如图所示装置进行实验制取漂白液(次氯酸钠和氯化钠的混合溶液),并提高次氯酸钠含量.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2和NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)试回答:
某化学活动小组欲用如图所示装置进行实验制取漂白液(次氯酸钠和氯化钠的混合溶液),并提高次氯酸钠含量.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2和NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molFeCl3溶液水解生成1molFe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 分子数为NA的N2,CO混合气体体积为22.4L,质量为28g | |
| C. | 0.5molFeBr2与足量氯气反应转移的电子数为NA | |
| D. | 足量Zn与一定量的浓硫酸反应,产生22.4L标准状况气体时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用滴定管前要检查是否漏液 | |
| B. | 用简易量热计测定反应热时,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应,以达到良好的实验效果 | |
| C. | 用精密pH试纸测得某浓度氯水的pH为3.5 | |
| D. | 燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CHCl3含有的原子总数为2.5NA | |
| B. | 25g质量分数为68%的H2O2溶液中含有氧原子数目为NA | |
| C. | 高温下,16.8gFe与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 1molCH5+中含有的电子数目为11NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com