
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
理论上,一个电池可以放电直到其中一个的电极完全耗尽为止。假如不再充电,电池工作到反应完全,若该电池放电电流为1.00 A(安培)。通过计算求:
(1)正、负极的电极材料,________极先消耗完。
(2)理论上该电池放电最长时间是多少小时?
科目:高中化学 来源: 题型:
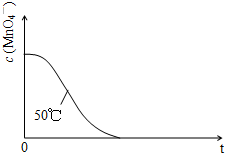 (2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.
(2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| ||
| △ |
| ||
| △ |
| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从海水提取溴,涉及到“浓缩”、“氧化”、“提取”等步骤,其中在“提取”过程中,可用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-离子和BrO3-离子,同时有二氧化碳气体生成。最后用硫酸酸化,单质溴又从溶液中析出。
(1)写出单质溴与碳酸钠溶液反应的化学方程式________________________________。
(2)用硫酸酸化时,每转移1 mol电子,可以生成单质溴___________ mol。
(3)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2 或KIO3,其本身被还原为Br2;
②Br2能将I¯ 氧化为I2;
③KIO3能将I¯氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
Br2、BrO3-、I2、IO3-的氧化性由强到弱的顺序为__________________________。
(4)以下离子方程式错误的是______________(选填答案编号)。
A.IO3-+ Br-→I-+ BrO3-
B.6I-+ BrO3-+ 6H + → 3I2 + Br-+ 3H2O
C.5I-+ 6BrO3-+ 6H + →3 Br2+ 5 IO3-+ 3H2O
D.5I-+ 2BrO3-+ 6H + → Br2 + IO3-+ 2I2 + 3H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
|
实验编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度 |
||
|
浓度(mol·L-1) |
体积(mL) |
浓度(mol·L-1) |
体积 (mL) |
||
|
① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
|
② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
|
③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
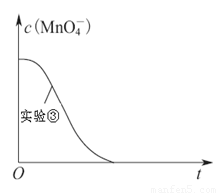
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第二次月考化学试卷(解析版) 题型:计算题
(10分)(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(2)已知:C3H8(g ) ==== CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如右表: 已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com