
下列叙述中正确的是( )
A.含有共价键的化合物一定是共价化合物 B.含有离子键的化合物一定是离子化合物
C.含非极性键的纯净物一定是单质 D.原子最外层2个电子的元素一定在ⅡA族
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在离子RO3n—中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+n+48 B.A-x+n+24
C.A-x-n-24 D.A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
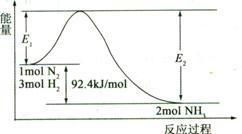
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的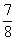 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是 ( )
A. CH4、CCl4都是含有极性键的非极性分子 B.NH3、CO、CO2都是极性分子
C.HF、HCl、HBr、HI的稳定性依次增强 D.CS2、H2O、C2H2都是直线形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E都是短周期元素,原子序数依次增大,元素B的原子价电子构型为ns2npn+2 。B、C同周期, C为周期表中电负性最大的元素,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴写出A、B、C、D、E元素符号___、___、___、___、___、
⑵B原子的电子排布图为_________________。D离子的电子排布式为______________________,甲、乙两分子中含有非极性共价键的物质的电子式是___________________,
⑶DBA中的化学键类型为____________、____________属于 化合物(填“离子”或“共价”)
⑷A的硫化物中,A原子以 杂化轨道成键,分子空间构型为 ;
(5)分别写出DBA水溶液与E、DBA与E的氧化物反应的化学方程式.
_____ ______ _______
_______ ______ _______ __
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸分子的结构式为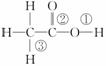 ,下列反应及断键部位正确的是( )
,下列反应及断键部位正确的是( )
(1)乙酸的电离,是①键断裂;
(2)乙酸与乙醇发生酯化反应,是②键断裂;
(3)在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2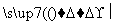 CH2Br—COOH+HBr,是③键断裂;
CH2Br—COOH+HBr,是③键断裂;
(4)乙酸变成乙酸酐的反应: 2CH3COOH―→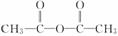 +H2O,是①②键断裂
+H2O,是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4) C.(2)(3)(4) D.(1)(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池的总反应式是H2+2NiO(OH) 2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
A.NiO(OH) B.Ni(OH)2 C.H2 D.H2和NiO(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法,正确的是 ( )
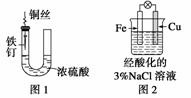
A.图1中 ,铁钉易被腐蚀
,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
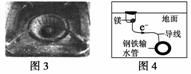
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com