
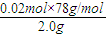 ×100%=78%,故答案为:78%.
×100%=78%,故答案为:78%.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
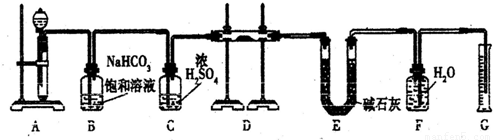
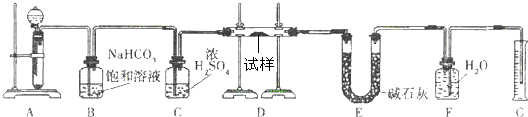
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置确定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)


回答下列问题:
(1)实验前必须检查装置的气密性。仪器连接好后,在 中加适量的水,关闭A中分液漏斗阀门后微热试管,若看到 说明装置气密性好。
(2)装置A中液体试剂选用盐酸而不用硫酸,理由是 。
(3)装置B的作用是 ;
装置C的作用是 ;
装置E中碱石灰的作用是 。
(4)装置D中发生反应的化学方程式是: 。
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com