
【题目】下列属于氧化还原反应的是
A. CaO+H2O=Ca(OH)2 B. 2NaOH+MgCl2=Mg(OH)2↓+2NaCl
C. SO2+H2O2=H2SO4 D. Cu(OH)2![]() CuO+H2O
CuO+H2O
科目:高中化学 来源: 题型:
【题目】t℃时,100mLNaNO3饱和溶液的质量为137g,如将这些溶液蒸干,获得62.5g NaNO3固体。下列说法中,不正确的是
A. t℃时,NaNO3饱和溶液密度为1.37g/cm3
B. t℃时,NaNO3的溶解度约为83.9g
C. t℃时,NaNO3饱和溶液中溶质的质量分数约为45.6%
D. t℃时,NaNO3饱和溶液中溶质的物质的量浓度约为1.61mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B. HS﹣的水解方程式:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
C. CO32﹣的水解方程式:CO32﹣+H2O![]() HCO3﹣+OH﹣
HCO3﹣+OH﹣
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如下图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
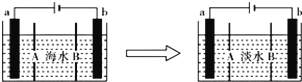
A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处运动
C. 通电后,a电极的电极反应式为4OH--4e-=== O2↑+2H2O
D. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SiO2制备高纯度硅的工业流程如图所示:

下列说法错误的是
A. SiO2与纯硅都是硬度大、熔沸点高的晶体
B. X为CO气体
C. 反应②产生的H2与反应③产生的HCl可以循环使用
D. 反应①②③均为在高温条件下的非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:

(1)写出图中③、④实验操作的名称依次是 ______ 、 ______
(2)写出装置④中所用玻璃仪器的名称 ______ 、 ______ 。
(3)下列实验需要在哪套装置中进行(填序号):
a、从海水中提取蒸馏水: ______ ; b、分离氯化钠和水: ______ ;
c、分离碳酸钙和水: ______ ; d、分离植物油和水: ______ ;
(4)装置②中玻璃棒的作用是__________________________________;
(5)装置 ③中冷却水低进高出的原因是_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:

(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: __________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:____________________________________。
(2)“转化”时加入NaOH的主要作用是________________________(用离子方程式表示)。
(3)上述工艺中可以循环利用的主要物质是________________、_________________和水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com