
【题目】下列说法正确的是( )
A.F2、Cl2、Br2、I2 熔点随原子序数的递增而降低
B.由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
C.原子序数为24的元素属于长周期的副族元素
D.金属Cs在空气中燃烧的产物是Cs2O
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)广泛应用于涂料、化妆品、食品以及医药等行业。利用黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]制备TiO2,工艺流程如下。已知: TiOSO4易溶于水,在热水中易水解生成H2TiO3,回答下列问题:

(1)(Mg0.5Fe0.5)Ti2O5中钛元素的化合价为_________,实验“焙烧”所需的容器名称是_________,“滤渣”的主要成分是__________________(填化学式)。
(2)制取H2TiO3的化学方程式为__________________。
(3)矿石粒度对TiO2的提取率影响如图,原因是____________。

(4)相关的金属难溶化合物在不同pH下的溶解度(s,mol·L-1)如图所示,步骤④应该控制的pH范围是_________(填标号)
A.1~2 B.2~3 C.5~6 D.10~11

(5)常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定钛白粉的纯度,其步骤为:用足量酸溶解ag二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100mL,取20.00mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+
①滴定终点的现象为_____________。
②滴定终点时消耗bmol· L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为_________。 (写表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。

(1)装置B的作用是___________________;装置D的作用是_______________________;
(2)利用实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,________(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度 ③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是______。
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤。①样品称量②加入________溶液(填化学式),搅拌、过滤③________(填操作名称)④_______(填操作名称)⑤称量碳酸钙
(5)乙同学利用如图装置测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活塞停留在10.00mL刻度处,反应结束后充分冷却,活塞最终停留在57.04mL刻度处。(上述气体体积均在标准状况下测定)试通过计算求样品中氢化钙的纯度:__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据外媒报道,WirthResearch公司公布了其用轻型氢燃料电池作为主要能源的无人空中系统(UAS)的设计,该轻型氢燃料电池比普通理离子电池具有更高的能量密度(能量密度是指单位体积或重量可以存储的能量多少)。用吸附了H2的碳纳米管等材料制作的二次电池的原理如下图所示。该电池的总反应为H2+2NiO(OH) ![]() 2Ni(OH)2,已知:6NiO(OH)+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法不正确的是
2Ni(OH)2,已知:6NiO(OH)+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法不正确的是
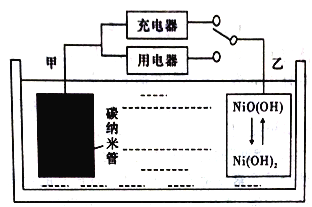
A. 碳纳米管吸附H2的密度越大,电池的能量密度越高
B. 电池可以用KOH溶液、氨水等作为电解质溶液
C. 放电时.乙电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D. 充电时,电池的碳电极与直流电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境保护、社会可持续发展密切相关,下列说法或做法合理的是
A. 进口国外电子垃圾,回收其中的贵重金属
B. 将地沟油回收加工为生物柴油,提高资源的利用率
C. 洗衣粉中添加三聚磷酸钠,增强去污效果
D. 大量生产超薄塑料袋,方便人们的日常生活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为![]() ,关于该有机物下列叙述正确的是
,关于该有机物下列叙述正确的是
A. 不能使酸性高锰酸钾溶液褪色
B. 不能使溴水褪色
C. 在加热和催化剂作用下,最多能和4mol H2反应
D. 一定条件下,能和NaOH醇溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50mL0.55molL-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是 ______ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H= ______ (结果保留一位小数)。
(3) ______(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置______________________________________________
(2)F元素的最高价氧化物对应的水化物的化学式为___________________________________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________________________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:__________________________________________________。
C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________________________。
(5)C、E的氢化物,沸点由高到低顺序是:_______________________________。
(6)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_______________。当转移电子为0.2mol时,标准状况下反应产生气体_______________L。
(7)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com