
| 1 |
| 2 |
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、第3周期ⅤB族 |
| B、第4周期ⅡB族 |
| C、第4周期Ⅷ族 |
| D、第4周期ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与足量稀硝酸反应,1 mol Fe失去电子数为3NA |
| B、常温常压下,22.4L 乙烯中含极性共价键数目为5NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
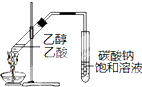
| A、配制银氨溶液:质量分数为2% 氨水中加入过量的硝酸银溶液 |
| B、制备乙酸乙酯:用如右图所示的实验装置 |
| C、鉴定溴乙烷中的溴原子:向溴乙烷中加入硝酸酸化的硝酸银溶液 |
| D、鉴别地沟油和矿物油:加入足量氢氧化钠溶液加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
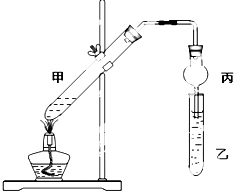 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| A、IA | B、ⅢA | C、ⅤA | D、ⅦA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com