
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有 。
(2) 可用尿素
可用尿素 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: 。当消耗掉12g尿素时,转移电子的物质的量是
。
。当消耗掉12g尿素时,转移电子的物质的量是
。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有:

则反应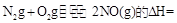 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
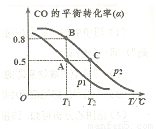
则该反应是 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
(5)工业上用氨水将来 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为
;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为
;已知25℃时,0.05mol/L(NH4)2SO4溶液的 ,则
,则 =
(用含a的代数式表示,已知
=
(用含a的代数式表示,已知 的电离常数
的电离常数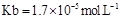 )。
)。
(1)NO、NO2、SO2(2分)
(2)1.2 mol(2分)
(3)179.8(2分)
(4)<(2分) 2(2分)
(5)c(NH4+)>c(SO42-)>c(H+)>c(OH-)(2分) 1.7×109-a (2分)
【解析】
试题分析:(1)酸雨分为硝酸型酸雨和硫酸型酸雨,所以NO、NO2、SO2都会引起酸雨。(2)尿素中C元素的化合价为+4价,反应中只有N元素变价,4molCO(NH2)2中-3价的N失去24mol电子,6molNO2中+4价的N得到24mol电子,生成7mol N2共转移24mol电子,则12g(0.2mol)尿素时消耗时,共转移1.2 mol电子。(3)求算反应N2(g)+O2(g)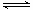 2NO(g)的ΔH,只用到前两个反应,ΔH1-ΔH2即可得到。(4)据图像可知,温度升高平衡逆向移动,所以ΔH<0。T1时,A点对应的α=0.5,据平衡常数表达式可得K=1。因B点与A点温度相同,K不变,可计算出体积为2L。(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,依据Kb的表达式和已知数据,可计算出结果为1.7×109-a。
2NO(g)的ΔH,只用到前两个反应,ΔH1-ΔH2即可得到。(4)据图像可知,温度升高平衡逆向移动,所以ΔH<0。T1时,A点对应的α=0.5,据平衡常数表达式可得K=1。因B点与A点温度相同,K不变,可计算出体积为2L。(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,依据Kb的表达式和已知数据,可计算出结果为1.7×109-a。
考点:本题以研究污染大气的有害气体性质为载体考查氧化还原反应、热化学反应、化学平衡及电解质溶液的相关知识。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
| b-2a |
| 2 |
| b-a |
| 2 |
| b-2a |
| 2 |
| b-a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 | B、日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com