
【题目】氯气是非常重要的化工产品,我国年产量在![]() t左右。氯气的实验室制备有多种不同方法。完成下列填空:
t左右。氯气的实验室制备有多种不同方法。完成下列填空:
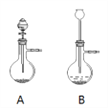
(1)漂粉精固体和盐酸混合即可反应产生氯气,相关的化学反应方程式为:_____________________________________________________。发生装置选择下图中A而不是B的理由是:______________________________
(2)实验室用此法制取纯净的氯气,可将混合气体通过盛有饱和食盐水的装置,目的是___________;为了将氯气干燥,可选用的干燥剂是___________。实验室用向上排空气法收集了一试管氯气,设计一个简单实验,验证所收集的氯气中是否收集满_________________________________________________。
(3)实验室用2.00mol/L盐酸和足量的漂粉精,若产生2.24L(标准状况)氯气,反应转移电子的物质的量是____________________,发生反应的盐酸________mL。
(4)为了比较氯、溴、碘单质的氧化性,将一定量氯气缓缓通入溴化钠溶液中时,可以看到无色溶液逐渐变为__________色;通入碘化钾溶液并加入少量苯振荡并静置后,可发现的现象______________________。
【答案】 Ca(ClO)2 + 4HCl → CaCl2 + 2Cl2↑+ 2H2O A装置便于控制反应的进程、可防止氯气等从漏斗口逸出,氯气逸出既污染空气又影响气体收集 除去氯气中的HCl 浓硫酸 将试管倒立在足量的氢氧化钠溶液中,观察试管中有无残留气体 0.1mol 100 黄 溶液分为两层,上层(苯层)为紫红色;下层几乎无色
【解析】试题分析:(1)漂粉精中的Ca(ClO)2与盐酸发生归中反应生成氯气、氯化钙、水;A装置氯气不能从漏斗口逸出,B装置氯气能从漏斗口逸出;(2)饱和食盐水能吸收氯化氢并能减小氯气的溶解度;氯气是酸性气体,可以用浓硫酸干燥;氯气能完全溶于氢氧化钠溶液;(3)根据电子转移的方向和数目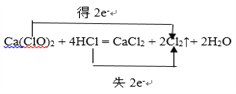 可知生成2mol氯气转移2mol电子、消耗4mol氯化氢;(4)氯气能把溴化钠中的溴置换出来;氯气能把碘化钾中的碘置换出来。
可知生成2mol氯气转移2mol电子、消耗4mol氯化氢;(4)氯气能把溴化钠中的溴置换出来;氯气能把碘化钾中的碘置换出来。
解析:(1)漂粉精中的Ca(ClO)2与盐酸发生归中反应生成氯气、氯化钙、水,反应方程式是Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2↑+ 2H2O;A装置氯气不能从漏斗口逸出,B装置氯气能从漏斗口逸出,氯气逸出既污染空气又影响气体收集,所以发生装置选择A而不选B;(2)饱和食盐水能吸收氯化氢并能减小氯气的溶解度,将混合气体通过盛有饱和食盐水的目的是除去氯气中的HCl;氯气是酸性气体,可以用浓硫酸干燥;氯气能完全溶于氢氧化钠溶液,将试管倒立在足量的氢氧化钠溶液中,观察试管中有无残留气体,若没有气体残留说明氯气已满;(3)根据 可知生成2mol氯气转移2mol电子、消耗4mol氯化氢,若产生2.24L(标准状况)氯气(0.1molCl2),反应转移电子的物质的量是0.1mol,发生反应的盐酸是0.2mol,体积是
可知生成2mol氯气转移2mol电子、消耗4mol氯化氢,若产生2.24L(标准状况)氯气(0.1molCl2),反应转移电子的物质的量是0.1mol,发生反应的盐酸是0.2mol,体积是![]() ;(4)氯气能把溴化钠中的溴置换出来,反应方程式是
;(4)氯气能把溴化钠中的溴置换出来,反应方程式是![]() ,所以可以看到无色溶液逐渐变为黄色;氯气能把碘化钾中的碘置换出来,反应方程式是
,所以可以看到无色溶液逐渐变为黄色;氯气能把碘化钾中的碘置换出来,反应方程式是![]() ,加入少量苯振荡并静置后,可发现的现象是溶液分为两层,上层(苯层)为紫红色;下层几乎无色。
,加入少量苯振荡并静置后,可发现的现象是溶液分为两层,上层(苯层)为紫红色;下层几乎无色。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】近期,多家白酒品牌被曝光塑化剂超标,根据检测结果,酒中主要的塑化剂成分是邻苯二甲酸二丁酯(DBP,结构简式为 ![]() ),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
A.DBP的分子式为C16H22O4
B.1mol DBP可以与5molH2反应
C.1mol DBP在碱性条件下水解时消耗4molNaOH
D.DBP所有原子在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.饱和氯水中Cl-、NO3-、Na+、SO32-可以大量存在
B.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
C.向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色,说明原溶液中有I-
D.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=S+2I-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的分散系
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸
⑥静置后,会析出黑色沉淀
A、①④⑥ B、②③④ C、②③⑤ D、②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
固体![]() 淡黄色溶液
淡黄色溶液![]() 淡红色溶液
淡红色溶液![]() 深红色溶液
深红色溶液![]() 溶液褪色
溶液褪色
(1)固体溶于稀盐酸的化学方程式为____________________________________________。
(2)试剂1的化学式是_______________________________;
加入试剂1后呈红色的原因是(用离子方程式表示)_______________________________。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成工业中原子利用率高、原料来源丰富、价格低廉且无污染,称其为“绿色化学”.以下反应中符合绿色化学原理的是( )
A.乙烯与氧气在银催化下生成环氧乙烷 ![]()
B.乙烷与氯气制备一氯乙烷
C.60℃时,乙炔与水在硫酸汞酸性溶液中合成乙醛
D.乙醇与浓硫酸共热制备乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1化学是目前研究的热点问题。
(1)己知:2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 H-H、O=O、H-O键的键能分别为436kJ/mol、496kJ/mol、462kJ/mol。则a=_______。
(2)以甲醇为原料制备H2的一种原理如下:
I.CH3OH(g) ![]() CO(g)+2H2(g) △H =+90kJ·mol-1
CO(g)+2H2(g) △H =+90kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
①在绝热恒容密闭容器中,加入一定量的CH3OH(g)在一定条件下发生反应I,下列情况能说明该反应达到平衡状态的是____________(填代号)
A.容器内温度不变
B.容器内气体总质量不再变化
C.CH3OH(g)和CO(g)的浓度之比不再变化
D.混合气体的密度不再变化
②温度为T℃时,向10L恒容密闭容器中充入1molCH3OH(g)和lmolH2O(g),发生反应I和反应II,达到平衡时测得CO的物质的量为0.4mol,CO2的物质的量为0.2mol。则反应II的平衡常数K=_____。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,则该时刻上述反应II的平衡移动方向为__________(填“正反应方向”、“逆反应方向”或“不移动”)。
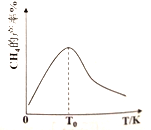
(3)H2和CO在一定条件(温度、压强和催化剂)下合成CH4,发生反应:CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
(4)合成气(H2、CO)不仅是化工原料,也是清洁能源。如果H2和CO以体积比1:1组成混合气体与空气构成碱性燃料电池(KOH溶液为电解质溶液且足量),假设CO和H2同时按比例发生反应,则燃料电池负极的电极反应式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com