
| A. | 可用溴水鉴别己烯、己烷和四氯化碳 | |
| B. | 可用酸性高锰酸钾溶液除去甲烷中混有的杂质乙烯 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
分析 A.溴水与三种有机物混合后现象不同,可鉴别;
B.乙烯被酸性高锰酸钾溶液氧化成二氧化碳,引进了新的杂质;
C.乙烷与氯气的反应产物为各种氯代烃的混合物,无法达到纯净的氯乙烷;
D.乙醇易挥发,挥发出的乙醇能够使酸性高锰酸钾溶液褪色,干扰乙烯的检验.
解答 解:A.四氯化碳、己烷和己烯与溴水混合的现象分别为:分层后有机色层在下层、分层后有机色层在上层、溴水褪色,现象不同,可鉴别,故A正确;
B.酸性高锰酸钾溶液能够将乙烯氧化成二氧化碳,产生了新的杂质,违反了除杂原则,故B错误;
C.将乙烷和氯气的混合气放在光照条件下反应,反应产物为氯代烃的混合物,无法达到纯净的溴乙烷,故C错误;
D.生成的乙烯中混有乙醇,乙醇也能够使酸性高锰酸钾溶液褪色,干扰了检验结果,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,涉及卤代烃性质、物质分离与提纯、物质鉴别等知识,明确常见有机物组成、结构与性质为解答关键,试题培养了学生的分析能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO 和 1molO2 充分反应,产物的分子数为2NA | |
| B. | 常温下,1L0.1mol/LnaCO3 溶液中含有的离子总数为0.3 NA | |
| C. | 0.1mol铁在0.1molCl2 中充分燃烧,转移的电子数为0.3 NA | |
| D. | 标况下,1.12L16O2 和1.12L18O2 均含有 0.1 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L酒精含有的分子数为NA | |
| B. | 500mL lmoL/L的盐酸中含有的HC1分子数为0.5 NA | |
| C. | 2.24LH2含有0.2NA个氢原子 | |
| D. | 通常状况下,71 g Cl2所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
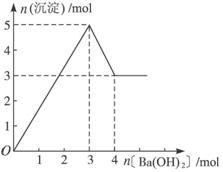 如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO 4 | B. | Al 2(SO 4) 3 | C. | Fe 2(SO 4) 3 | D. | NaAlO 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、重结晶 | B. | 分液、蒸馏、萃取 | ||
| C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基含10 NA个电子 | |
| B. | 标准状况下,11.2L四氯化碳所含分子总数为0.5NA | |
| C. | 1 mol聚乙烯含有的原子总数目为6NA | |
| D. | 20℃时,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com