
 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m2、m5 |
分析 (1)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),装置A中发生反应为碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;碳酸钠晶体失水生成碳酸钠和水;
(2)装置B中的浓硫酸具有吸水性,可以吸收气体中的水蒸气;装置C中是碱石灰用来吸收碳酸氢钠分解生成的二氧化碳气体;
(3)实验过程中通入N2的目为把生成的水蒸气和二氧化碳气体全部赶到BC装置中完全吸收;
(4)由题意可知生成水的质量是(m4-m2)g,生成二氧化碳的质量为(m5-m3)g,原样品质量为m1g,可以利用生成的二氧化碳质量计算碳酸氢钠的质量,也可以由生成水的质量列方程组计算碳酸氢钠的质量,若再知道原样品质量即可计算碳酸氢钠的质量分数,所以利用ce组数据能计算,利用B组数据可以由生成二氧化碳的质量计算碳酸氢钠质量,再由生成水的质量计算得到碳酸钠晶体质量,进一步可以求碳酸氢钠质量分数;
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,可以利用二氧化碳质量计算,利用实验中所提供的数据得到准确的w(NaHCO3).
解答 解:(1)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),装置A中发生反应为碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;碳酸钠晶体失水生成碳酸钠和水,反应的化学方程式为:Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O;
(2)装置B中的浓硫酸具有吸水性,可以吸收气体中的水蒸气;装置C中是碱石灰用来吸收碳酸氢钠分解生成的二氧化碳气体;
故答案为:吸收反应生成的水蒸气;吸收反应生成的二氧化碳;
(3)实验过程中通入N2的目为把生成的水蒸气和二氧化碳气体全部赶到BC装置中完全吸收;
故答案为:使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收;
(4)由题意可知生成水的质量是(m4-m2)g,生成二氧化碳的质量为(m5-m3)g,原样品质量为m1g,可以利用生成的二氧化碳质量计算碳酸氢钠的质量,也可以由生成水的质量列方程组计算碳酸氢钠的质量,若再知道原样品质量即可计算碳酸氢钠的质量分数,所以利用ce组数据能计算,利用B组数据可以由生成二氧化碳的质量计算碳酸氢钠质量,再由生成水的质量计算得到碳酸钠晶体质量,进一步可以求碳酸氢钠质量分数;
故答案为:bce;
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,可以利用二氧化碳质量计算,利用实验中所提供的数据得到准确的w(NaHCO3)=$\frac{\frac{{m}_{5}-m{\;}_{3}}{44}×84}{{m}_{1}}$×100%=$\frac{42({m}_{5}-{m}_{3})}{11m{\;}_{1}}$×100%;
故答案为:$\frac{42({m}_{5}-{m}_{3})}{11m{\;}_{1}}$×100%.
点评 本题考查了物质组成的实验探究方法和实验过程分析判断,主要是实验流程的理解应用,掌握基础是关键,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 向100mL 1mol/L盐酸溶液中加入4g NaOH固体 | |
| B. | 向100mL 1mol/L的醋酸溶液中通适量NH3气体 | |
| C. | 向饱和和澄清石灰水中通少量CO2气体 | |
| D. | 通足量的氯气于氢氧化钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点,滴入最后一滴高锰酸钾溶液,溶液颜色恰好由紫红色变为无色且半分钟不变色 | |
| B. | 燃料电池制作的实验中,石墨棒用海绵包裹是为了更好的固定电极 | |
| C. | pH试纸在检测溶液时不能湿润,使用石蕊试纸检测气体时需要湿润并粘在洁净玻璃棒的一端 | |
| D. | 海带中提取碘,可将灰化后的海带加水煮沸一段时间后过滤,在滤液中加入稀硫酸后转移到分液漏斗中用CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 是酸性氧化物,不溶于水,也不能与任何酸发生反应 | |
| B. | Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同 | |
| C. | CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在 | |
| D. | 浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
.H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
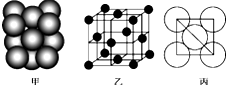 铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
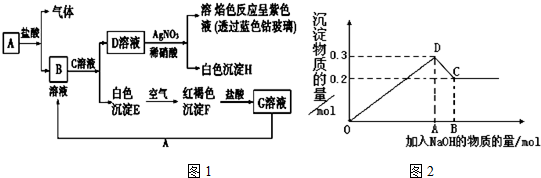
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com