
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O |
| B、用食醋除去暖水瓶中的水垢:2H++CaCO3═Ca2++CO2↑+H2O |
| C、少量SO2滴入NaClO溶液中:SO2+2ClO-+H2O═SO32+2HClO |
| D、向水玻璃中通入足量CO2:SiO32-+2CO2+2H20═H2SiO3↓+2HCO3- |


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、已知稀盐酸和稀NaOH溶液反应生成1molH2O时放出57.3kJ的热量,则稀硫酸和氢氧化钡溶液反应生成1molH2O时也放出57.3kJ的热量 | ||
B、C(石墨)+
| ||
| C、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | ||
| D、已知:①S(g)+O2(g)=SO2(g)△H=akJ.mol-1②S(s)+O2(g)=SO2(g)△H=bkJ.mol-1,则a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焓变是指1 mol物质参加反应时的能量变化 |
| B、反应放热时,△H>0;反应吸热时,△H<0 |
| C、在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同 |
| D、在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀硫酸反应 |
| B、灼热的碳与CO2反应 |
| C、Ba(OH)2?8H2O与NH4Cl的反应 |
| D、甲烷在O2中的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅与氢氧化钠溶液反应:SiO2+2Na++2OH-=NaSiO3+H2O |
| B、向Ba(OH)2溶液中逐滴滴入NaHSO4溶液至溶液刚好呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| D、向碳酸氢钠溶液中滴入少量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B、HF、HCl、HBr、HI的热稳定性依次减弱 |
| C、H2O熔沸点高于H2S.HF熔沸点高于HCl |
| D、NaF、NaCl、NaBr、Nal的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
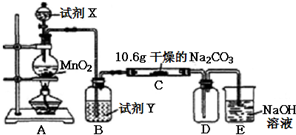
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. |  |
| 步骤2:向A试管中滴加 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com