
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
【答案】D
【解析】
A.冰中1个水分子周围有4个水分子通过氢键连接,每个水分子相当于含有2个氢键,所以1mol冰中,氢键的数目是2NA,故A错误;
B.铁为阳极,Fe-2e-=Fe2+,Cr2O72-与亚铁离子发生氧化还原反应生成Cr3+和三价铁离子,其离子方程式为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;得关系式:Fe2+~2e-~~![]() Cr2O72-,当电路中通过6mole-,有0.5molCr2O72-被还原,故B错误;
Cr2O72-,当电路中通过6mole-,有0.5molCr2O72-被还原,故B错误;
C.所以标准状况下,22.4LNO2物质的量为:![]() =1mol,含有的原子数等于3NA,故C错误;
=1mol,含有的原子数等于3NA,故C错误;
D.依据分解化学方程式和盐酸化合价变化计算电子转移,1mol LiAlH4在125℃完全分解成LiH、H2、Al,化学方程式为:LiAlH4=LiH+H2↑+Al,转移电子3NA,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示,已知有机物A,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种聚合物,生活中用于制造食物保鲜膜。

(1)写出B中官能团的电子式___;
(2)写出下列物质转化的化学方程式:
B→C:___;
B+D→E:___;
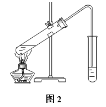
Ⅱ.(3)在实验室可以用如图2所示的装置进行B与D的反应,装置中通蒸气的导管要插在___溶液的液面上方,若要把制得的乙酸乙酯分离出来,应采用的实验操作是___。
Ⅲ.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图3所示:
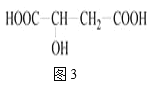
(4)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(5)在一定条件下,苹果酸可能与下列哪些物质发生反应___?
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ·mol-1
②N2O4(l)=N2(g)+2O2(g) △H2=+204.3 kJ·mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=________。
(2)已知反应N2H4(g)+ 2Cl2(g)N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_____________。
②M点时,N2H4的转化率为_____________(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 molCl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡_________________(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下1.0 mol·L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=________。
②用次磷酸钠通过电渗析法制备次磷酸.装置如图所示。交换膜A属于_________(填“阳离子”或“阴离子”)交换膜,当电路中流过3.8528×105库仑电量时,制得次磷酸的物质的量为______(一个电子的电量为1.6×10- 19库仑,NA数值约为6. 02× 1023)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铁的化合物的说法中,错误的是( )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色
B.如图所示操作可制取Fe(OH)2
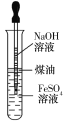
C.Fe3O4、Fe(OH)3都可以由化合反应制得
D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.原子数目相等的三种气体,质量最大的是Z
B.同温同压下,同质量的三种气体,气体密度最小的是X
C.同温同压下,三种气体体积均为6.72 L,则它们的物质的量一定均为0.3 mol
D.同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为__mol,含溶质MgCl2的质量为__g。
(2)该混合液中CaCl2的物质的量为__mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丁酸氮芥是氮芥类抗癌药的代表物,其合成路线如图所示:
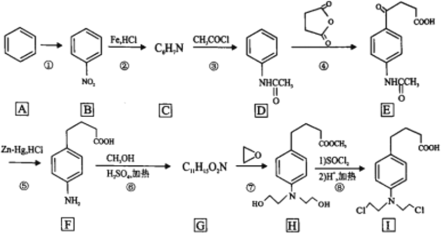
回答下列问题:
(1)反应①所需的试剂和条件是______________,B中的官能团名称是______________
(2)C的结构简式为______________。
(3)写出具有苯环结构,既能发生银镜反应又能发生水解反应的D的同分异构体的结构简式______________。(不考虑立体异构,只需写出3个)
(4)②的反应类型是______________。
(5)写出F到G的反应方程式______________。
(6)设计由苯和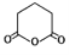 制备
制备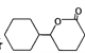 的合成路线(无机试剂任选)。______________
的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
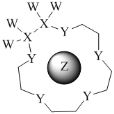
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 6.02×1023就是阿伏加德罗常数
B. 1 mol水中的氢原子数目为2NA
C. 阿伏加德罗常数个粒子的物质的量是1 mol
D. 1 mol 氨气所含原子数约为2.408×1024个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com