
【题目】下列有关原子结构和元素周期律表述正确的是
A. 原子序数为15的元素的最高化合价为+3
B. 第ⅦA族元素是同周期中非金属性最强的元素
C. Li、 Na、K、Rb、Cs的得电子能力逐渐增强
D. 原子序数为16的元素位于元素周期表的第三周期的IVA族
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某学生用0.10molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH= , (含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定﹣﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 23.40 |
第二次 | 25.00 | 4.00 | 23.90 |
第三次 | 25.00 | 5.00 | 25.10 |
①滴定时,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为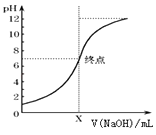
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 无论乙烯的加成,还是乙烷的取代反应都可制得氯乙烷
B. 使用溴水或酸性高锰酸钾溶液都可以除去乙烷中的乙烯杂质
C. 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用氧化铝与焦炭在氮气流中加强热制备氮化铝(AlN),氮化铝样品中含少量Al4C3、C、Al2O3杂质。某实验小组拟测定ag氮化铝样品中Al4C3含量并探究甲烷与氧化铜反应的氧化产物为CO2。
已知:(Ⅰ)AlN、Al4C3都能与水反应,分别生成NH3、CH4。
(Ⅱ)CH4还原氧化铜:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。

(1)装置连接顺序为 ________________________(按气流从左至右)。
(2)写出A中发生反应的化学方程式:AlN和稀硫酸反应:__________________________;Al4C3与
稀硫酸反应:_______________________________________________________________________。
(3)有下列操作步骤:
①缓缓向A中通入一定量的N2。
②称量B(酒精灯、木块和铁架台除外),按顺序组装仪器,检查装置的气密性,将样品放入烧瓶中;
③点燃B处酒精灯;
④再次称量B;
⑤从分液漏斗中缓慢滴入稀硫酸,直到不再产生气体为止;
⑥再次缓慢通入一定量的N2。
正确的操作顺序是_________________________;操作①的目的是_______________;若操作③与操作⑤顺序颠倒, 将导致测得的Al4C3的质量分数_________(填“偏大”“偏小”或“不变”)。
(4)设计实验证明A中有NH4+生成:__________________________________。
(5)实验结束后,测得B中固体质量减少bg,则样品中Al4C3的质量分数为________×100%。
(6)通过测定C中生成BaCO3的质量可以确定甲烷与氧化铜反应是否有CO生成。实验完毕后,测得B
中固体质量减少bg;对C中混合物进行过滤、洗涤、干燥、称重,当m(BaCO3)=________g时(用含b表达式表示),表明氧化产物只有CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式.
(3)写出有机物A可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为
(2)a、b、c三点处,电离程度最大的是
(3)表是几种常见弱酸的电离平衡常数(25℃):
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOHCH3COO﹣+H | K=1.76×10﹣5 |
H2CO3 | H2CO3H++HCO3﹣H2CO3﹣H++HCO32﹣ | K1=4.31×10﹣7K2=5.61×10﹣11 |
HClO | HClOH++ClO﹣ | K=3.0×10﹣8 |
CH3COOH、H2CO3、HClO,其中酸性最强的是 , 最弱的是
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4
②NH3H2O . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com