
A、B、C三个烧杯中分别盛有物质的量浓度相同的足量稀硫酸。
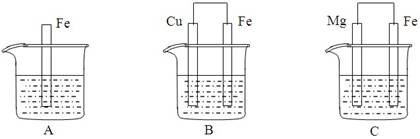
⑴A中反应的离子方程式为____________________________________________________
⑵B中Fe电极所发生反应的电极反应式为_________________________________,
⑶C中若正极产生112mL气体(标准状况),则负极金属质量减少_____________g。
⑷比较A、B、C中铁被腐蚀的速率由快到慢的顺序是____________________(填字母)。
⑴Fe+2H+=Fe2++H2↑ (2分) ⑵Fe-2e-=Fe2+ (1分)
(3)0.12g (2分) (4)B A C (2分)
【解析】(1)A不能构成原电池,铁和稀硫酸直接发生置换反应,生成氢气和硫酸亚铁,离子方程式为Fe+2H+=Fe2++H2↑。
(2)B构成原电池,由于原电池中较活泼的金属作负价,失去电子,发生氧化反应。所以铁是负极,铜是正极。负极反应式为Fe-2e-=Fe2+。
(3)C也构成原电池,镁比铁活泼,所以镁是负极,铁是正极。正极生成的氢气是112ml,在标准状况下的物质的量是0.005mol,根据电子得失守恒可知,负极减少的镁是0.005mol×24g/mol=0.12g。
(4)B中铁是负极,腐蚀速度最快,C中铁是正极,被保护,所以A、B、C中铁被腐蚀的速率由快到慢的顺序是B A C。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:上海市杨浦区2011届高三一模化学试题 题型:021
|
浓度相同的NaOH溶液各100 ml倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是
| |
A. |
原NaOH溶液的浓度为0.2 mol/L |
B. |
B烧杯中通入的CO2体积为448 mL |
C. |
通入CO2后,不能确定A烧杯中的溶质 |
D. |
通入CO2后,C烧杯中溶质成分的物质的量之比为 n(NaOH)∶n(Na2CO3)=2∶1 |
查看答案和解析>>
科目:高中化学 来源:上海市闵行区2010届高三第二次模拟考试化学试卷 题型:选择题
常温下,在a、b、c三个盛有相同体积、相同浓度的稀H2SO4的烧杯中,分别加入等质量的表面积相同的锌。然后在a中同时加入适量CuSO4溶液,c中加入适量的无水CH3COONa固体。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省保定市高一(下)期末化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com