
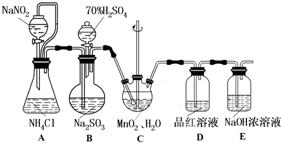
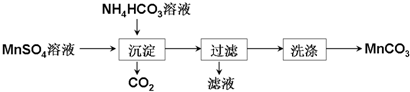
分析 以MnO2为原料制备少量高纯MnCO3的实验探究,涉及利用装置A制备氮气、装置B制备SO2气体,利用N2和SO2混合气体与MnO2在装置C中发生氧化还原反应得到MnSO4溶液,再将所制MnSO4溶液与NH4HCO3溶液混合可得到MnCO3沉淀,通过过滤洗涤最终得到目标产物MnCO3样品;
(1)装置A中是利用NaNO2和NH4Cl混合发生氧化还原反应生成N2及NaCl和水,可结合电子守恒和原子守恒配平得到此反应方程式;
(2)为保证气体能完全与溶液反应,通常可通过控制气流速度、增大与溶液的接触面积或改变反应体系的温度来实现;SO2气体具有漂白性,能使品红褪色;
(3)①由流程图可知,MnSO4溶液与NH4HCO3溶液混合可得到MnCO3沉淀和CO2气体,可结合电荷守恒和原子守恒配平得到此反应的离子方程式;
②乙醇能与水相互混溶且易挥发,通常无机盐在乙醇中的溶解度很小,另外Mn2+易被氧化;
③MnSO4溶液中Mn2+可以和OH-作用生成Mn(OH)2,也可以和CO32-作用生成MnCO3沉淀,更容易生成Mn(OH)2.
解答 解:以MnO2为原料制备少量高纯MnCO3的实验探究,涉及利用装置A制备氮气、装置B制备SO2气体,利用N2和SO2混合气体与MnO2在装置C中发生氧化还原反应得到MnSO4溶液,再将所制MnSO4溶液与NH4HCO3溶液混合可得到MnCO3沉淀,通过过滤洗涤最终得到目标产物MnCO3样品;(1)装置A中是利用NaNO2和NH4Cl混合生成N2及NaCl和水,反应方程式为:NaNO2+NH4Cl$\frac{\underline{\;△\;}}{\;}$ N2↑+NaCl+2H2O,故答案为:NaNO2+NH4Cl$\frac{\underline{\;△\;}}{\;}$ N2↑+NaCl+2H2O;
(2)通过控制N2和SO2混合气体气流速度、增大SO2与溶液的接触面积或改变反应体系的温度可使SO2尽可能转化完全;当有SO2气体通过品红溶液时,品红会快速褪色;故答案为:控制适当的温度或缓慢通入混合气体或增大SO2与MnO2的接触面积;品红颜色(迅速)变浅(或褪去);
(3)①MnSO4溶液与NH4HCO3溶液混合可得到MnCO3沉淀和CO2气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
②MnCO3在乙醇中几乎不溶,利用乙醇洗涤MnCO3既可减小MnCO3的溶解损失,也能除去表面水分防止MnCO3潮湿时被空气氧化,故答案为:洗去MnCO3固体表面的水,防止MnCO3潮湿时被空气氧化;
③MnSO4溶液中缓慢滴入Na2CO3溶液,酸性条件下生成MnCO3,而改为向 Na2CO3溶液中缓慢滴加Mn2+溶液,碳酸钠溶液的碱性强,易生成Mn(OH)2,则加料方式为:将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中,碳酸钠溶液的碱性强,避免先生成Mn(OH)2,故答案为:c;
点评 以制备MnCO3的无机流程题,涉及气体的制备、氧化还原反应的分析与应用(方程式的书写与配平)、混合物的分离提纯,属基础考查,难度中等,对学生灵活利用题设条件分析问题解决问题的能力要求较高.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 将苯与浓硝酸和浓硫酸的混合酸共热至50℃~60℃制硝基苯 | |
| C. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| D. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键在形成蛋白质结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子光谱可用于测定物质中元素的种类 | |
| C. | 门捷列夫为元素周期律和元素周期表的发现做出了突出贡献 | |
| D. | 空气、水、煤、天然气均为可再生资源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com