
【题目】按要求回答下列问题:
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是________;不溶于水,且密度比水小的是________。
(2)一瓶无色气体,可能含有CH4和CH2=CH2或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐退去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确?________(填“正确”或“不正确”),理由是______________________。
②上述实验可能涉及的反应类型有_________________________。
(3)含有![]() 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合而成的,其化学方程式是________________________。
聚合而成的,其化学方程式是________________________。
②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯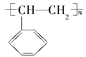 ,它是由________(写结构简式)聚合而成的。
,它是由________(写结构简式)聚合而成的。
【答案】乙醇 苯、汽油 不正确 因为CH2=CH2也可以与Cl2发生加成反应,而使黄绿色逐渐退去,生成的CH2ClCH2Cl也是油状液体 取代反应、加成反应 ![]()
![]()
【解析】
(1)大多数有机物不溶于水,而乙醇与水混溶,苯、汽油的密度比水小;
(2)①乙烯和氯气发生反应,甲烷和氯气发生反应;
②乙烯和氯气发生加成反应,甲烷和氯气发生取代反应;
(3)①聚氯乙烯塑料不具有可塑性,为线型分子,由氯乙烯发生加聚反应制取;
②聚苯乙烯由苯乙烯![]() 发生加聚反应产生。
发生加聚反应产生。
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是含羟基的物质-乙醇;而不溶于水,且密度比水小的纯净物为苯,汽油为混合物。即不溶于水、密度比水小的物质有汽油、苯;
(2)①乙烯可以和氯气发生加成反应,而使黄绿色逐渐褪色,生成的CH2ClCH2Cl是油状液体;而甲烷也可以和氯气发生取代反应,生成的CH2Cl2、CHCl3、CCl4都是无色油状液体,都能使黄绿色逐渐褪去;因此不能由上述实验现象推断出该瓶气体中一定含有CH4;
②乙烯和氯气发生加成反应,甲烷和氯气发生取代反应;
(3)①聚氯乙烯塑料为线型分子,可由氯乙烯发生加聚反应制取,该反应为![]() ;
;
②苯乙烯![]() 发生加聚反应产生聚苯乙烯。
发生加聚反应产生聚苯乙烯。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
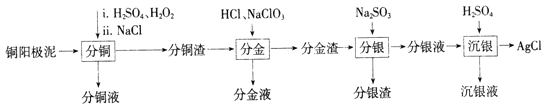
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
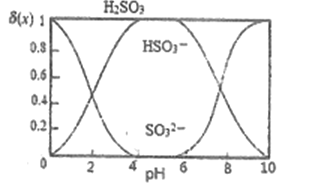
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是人体细胞中三种重要有机物A、C、E的元素组成及相互关系图,下列说法错误的是( )
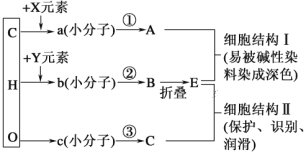
A. 图中X所指的元素为N、P
B. A的中文名称为脱氧核糖核酸,其彻底水解的产物是脱氧核苷酸
C. E具有多样性,其根本原因是基因具有多样性
D. 过程②叫做脱水缩合,在核糖体上完成, 细胞结构Ⅱ可以辨别膜的内侧和外侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆70周年大典上,放飞的气球由可降解材料制作,内充的气体是比氢气安全的氦气。下列关于氦的说法正确的是( )
A.氦气比氢气活泼B.氦气的密度比空气大
C.氦气的分子式为He2D.氦原子最外层电子数为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积相同的甲、乙两容器中,分别充有等物质的量的SO3气体,在相同温度下发生反应2SO3(g)![]() O2(g)+2SO2(g)并达到平衡。在这一过程中甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO3的转化率为P%,则乙容器中SO3的转化率
O2(g)+2SO2(g)并达到平衡。在这一过程中甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO3的转化率为P%,则乙容器中SO3的转化率
A. 等于P% B. 大于P% C. 小于P% D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)又称肼,是一种良好的火箭燃料,与适量氧化剂混合可组成液体推进剂,无水N2H4液体有微弱氨气的气味。
(1)N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-622 kJ/mol,试计算1 mol气态肼与二氧化氮完全反应时放出的热量为_______。
(2)在加热条件下,液态肼可还原新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,试写出该反应的化学反应方程式_______________________________。
(3)以气态肼为原料的碱性燃料电池的总反应为N2H4+O2=N2+2H2O,放电时负极的反应方程式为______________________________
(4)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程 N2H4+H2O![]() N2H5++OH-,试写出第二步电离过程____________________________。常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中水电离出的c(H+)=_______________。
N2H5++OH-,试写出第二步电离过程____________________________。常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中水电离出的c(H+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
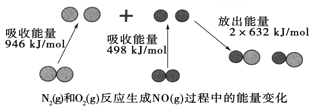
下列说法中正确的是
A. 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验方案合理的是( )
A.用乙醇萃取碘水中的I2B.用碱石灰干燥NH3
C.往浓硫酸中加水稀释配制稀硫酸D.用NaOH除去K2SO4中的MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com