
| A. | +8QkJ/mol | B. | +16Q kJ/mol | C. | -8Q kJ/mol | D. | -16Q kJ/mol |
分析 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,丁烷燃烧热的反应为:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l),CO2恰好与KOH溶液完全反应生成正盐为K2CO3,2KOH+CO2═K2CO3+H2O,根据n=c×V计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒有n(CO2)=n(K2CO3),据此求解放出热量为Q kJ的丁烷的物质的量,反应热与化学计量数成正比,结合丁烷燃烧热的方程式C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)求△H.
解答 解:燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,丁烷燃烧热的反应为:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l),
KOH的物质的量为n(KOH)=c×V=0.1L×5mol/L=0.5mol,2KOH+CO2═K2CO3+H2O,
根据钾离子守恒,故n(K2CO3)=0.5mol×$\frac{1}{2}$=0.25mol,
根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,
C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l),
根据碳元素守恒可知,丁烷的物质的量为n(C4H10)=0.25mol×$\frac{1}{4}$=$\frac{1}{16}$mol,
即 $\frac{1}{16}$mol丁烷完全燃烧放出的热量大小为QkJ,
故1mol丁烷完全燃烧放出的热量为QkJ×$\frac{1mol}{\frac{1}{16}mol}$=16QkJ,
则此条件下丁烷燃烧热的方程式为C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-16QkJ/mol,
故选D.
点评 本题考查反应热的计算,根据氢氧化钾确定丁烷的物质的量是解答该题的关键,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |
 .
.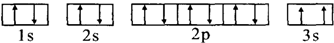 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 同物质的量的物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体熟石灰和氯化铵混合加热 | |
| B. | 加热试管中的氯化铵固体 | |
| C. | 将烧瓶中的浓氨水加热 | |
| D. | 将分液漏斗中的浓氨水滴入装有碱石灰的烧瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com