
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是 ( )。
A.氢气的燃烧热为241.8 kJ·mol-1
B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1
C.盐酸和氨水混合的热化学方程式:
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
D.由③可知金刚石不及石墨稳定
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 元素及其化合物练习卷(解析版) 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。

Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第8讲电化学练习卷(解析版) 题型:选择题
Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )。

A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第6讲反应速率和化学平衡练习卷(解析版) 题型:选择题
在一密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,探讨温度对反应的影响,实验结果如下图所示(注:T1,T2均大于300 ℃),下列说法正确的是( )。

A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第5讲化学反应与能量练习卷(解析版) 题型:填空题
(创新预测题)将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是
_______________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______________________________________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第5讲化学反应与能量练习卷(解析版) 题型:选择题
下列关于化学反应的描述中正确的是( )。
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,也放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-283.0 kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则b>a
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第4讲周期律 物质结构练习卷(解析版) 题型:选择题
已知A、B、C、D为短周期主族元素,其相对位置关系如图。C与B可形成离子化合物C3B2。下列分析正确的是( )。

A.电负性:C>A
B.离子氧化性:C>D
C.氢化物稳定性:A>B
D.原子半径:r(C)>r(B)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第2讲化学常用计量练习卷(解析版) 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第11讲有机化学基础练习卷(解析版) 题型:填空题
某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下。

已知:
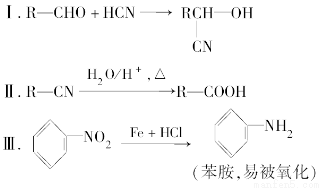
请回答下列问题:
(1)C的分子式为________。
(2)下列对相关反应类型的判断合理的是________(填序号)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:_____________________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有________种,写出其中一种的结构简式:________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为__________________________________________。
②写出反应Ⅴ的化学方程式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com