
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O
⑴用双线桥法分析上述反应(只需标出电子得失的方向和数目)
⑵上述反应中氧化剂是  ,氧化产物是 。硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的 。
,氧化产物是 。硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的 。
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确是 ( )
A.x等于6 B. 易溶于强酸和强碱
C. 用氧化物形式表示:BaO·CuO·2SiO2 D.性质稳定,不易褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2+ +Cl2 =2Fe3+ +2Cl-
则有关离子的还原性由强到弱的顺序为( )。
A.Cl->Fe2+>I- B. Fe2+>I->Cl-
C.I->Fe2+>Cl- D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源: 题型:
H-是负一价的阴离子,它可与NH3发生以下反应:H-+NH3 = H2+NH2-,下列有关这个反应的说法中正确的是( )。
A.它属于置换反应 B.该反应中H-是还原剂
C.该反应中NH3被氧化 D.反应中被氧化和被还原的元素都是H元素
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有钠、钾及钠钾合金,对于它们三者熔点高低比较正确的是( )
A.钠钾合金>钠>钾 B.钠>钾>钠钾合金
C.钠>钠钾合金>钾 D.钾>钠钾合金>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5︰6,则甲、乙两烧杯中的反应情况可能分别是( )
A. 甲、乙中都是铝过量 B. 甲中铝过量、乙中碱过量
C. 甲中酸过量、乙中铝过量 D. 甲中酸过量、乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2+2CH3OH―→CO(OCH3)2+H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。
计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。
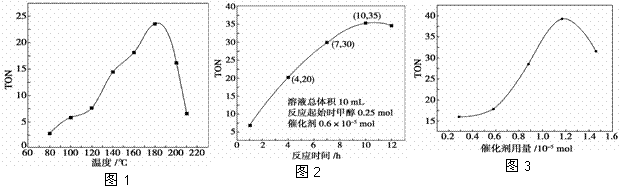 (1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
(1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
(2)根据反应温度对TON的影响图(图1)判断该反应的焓变ΔH________0(填“>”、“=”或“<”),理由是_________________。
(3)根据反应时间对TON的影响图(图2),已知溶液总体积 10 mL,反应起始时甲醇0.25 mol,催化剂0.6×10-5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量TON的影响图(图3),判断下列说法正确的是________。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是
A.0.5molNaCl溶解在1 L水中,所得溶液的物质的量浓度为0.5 mol/L
B.10mL 1 mol/L的硫酸溶液与100mL 0.1mol/L的硫酸溶液的物质的量浓度相同
C.1mol任何气体所含的气体分子数目都相等
D.1molCH4的体积约为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com