


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
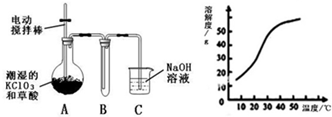 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:
,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电能力增强 |
| B、溶液中c(H+)/c(CH3COOH)增大 |
| C、醋酸的电离程度增大,c(H+)亦增大 |
| D、电离平衡左移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com