
| 元素 | A | B | C | D | E | F | G | H |
| 原子半 径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要 化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
分析 A、C的主要化合价都是+2,应该处于ⅡA族,原子半径A>C,故A为Mg、C为Be元素;D、E都有-2价,但E没有正化合价,则E为O元素、D为S元素;B为+3价,其原子半径大于S、小于Mg,则B为Al元素;F、G的主要化合价为+1,应该处于ⅠA族,原子半径F>Mg,则F为Na元素;G的原子半径小于Be,则G只能为H元素;H为+7价,则位于ⅤⅡA族,则H为Cl元素,据此进行解答.
解答 解:A、C的主要化合价都是+2,应该处于ⅡA族,原子半径A>C,故A为Mg、C为Be元素;D、E都有-2价,但E没有正化合价,则E为O元素、D为S元素;B为+3价,其原子半径大于S、小于Mg,则B为Al元素;F、G的主要化合价为+1,应该处于ⅠA族,原子半径F>Mg,则F为Na元素;G的原子半径小于Be,则G只能为H元素;H为+7价,则位于ⅤⅡA族,则H为Cl元素,
(1)E、F、G分别为O、Na、H,其形成的化合物为NaOH,氢氧化钠中存在离子键和共价键,
故答案为:离子键和共价键;
(2)B、H两元素的最高价氧化物所对应的水化物分别为Al(OH)3、HClO4,二者反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)实验室中用二氧化锰与浓盐酸加热制取氯气,反应的化学方程式是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,涉及离子方程式、化学方程式书写、化学键类型判断等知识,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
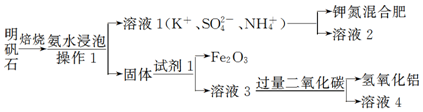
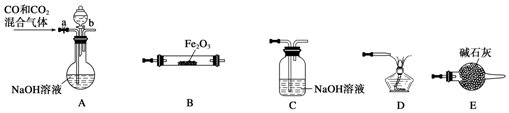
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的密度不变时.说明达到了平衡状态 | |
| B. | 加入少量的X,△H变大 | |
| C. | 加入一定量的惰性气体,平衡向左移动 | |
| D. | 加入少量的Y正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
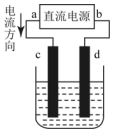
| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 300mL | C. | 490mL | D. | 720mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
| B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
| D | 升高温度 | 逆反应速率增大量大于 正反应速率增大量 | Z的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论解释 |
| A | 过量铁粉与稀HNO3充分反应后滴入KSCN溶液 | 溶液变红 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质,他们用这种方法清洗一批做了银镜反应实验的试管,配制Fe3+的浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管 | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗干净 | Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 在苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸的酸性比苯酚的强,溶液中还有Na2CO3生成 |
| D | 向硅酸钠溶液中滴入酚酞溶液,再滴加稀盐酸 | 溶液变红,后溶液红色变浅直至消失 | 非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的体积百分含量保持不变 | |
| B. | SO2速率是O2速率的2倍 | |
| C. | SO3的浓度是O2浓度的2倍 | |
| D. | 单位时间内SO2消耗的浓度等于SO3生成的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com