
【题目】(1)等质量的O2和O3所含分子个数比为___,原子个数比为___。
(2)400mL2.0mol/L的Al2(SO4)3溶液中含Al3+的物质的量为___,从中取出10mL,将这10mL溶液用水稀释到100mL,所得溶液中SO42-的物质的量浓度为___。
(3)0.5 molCH4的质量为___;标准状况下,4.48LNH3所含分子数为___。
(4)等物质的量的CH4和N2,所含原子数之比为___,等质量的CH4和N2物质的量之比为___。
(5)3.5molBa(OH)2中含有___个OH-,2.5molNaOH的摩尔质量为__。
【答案】3∶2 1∶1 1.6mol 0.6mol/L 8g 0.2NA 5∶2 7∶4 7NA 40g/mol
【解析】
(1)根据n=![]() 、N= n×NA及分子构成计算;
、N= n×NA及分子构成计算;
(2)根据n=cV进行计算,稀释前后溶质的物质的量保持不变;
(3)依据n=![]() 计算,根据n=
计算,根据n=![]() 计算;
计算;
(4)1个CH4含有5个原子,1个N2含有2个原子,等物质的量的CH4和N2,分子个数相等;依据n=![]() 可知,质量相等时,n与M成反比计算;
可知,质量相等时,n与M成反比计算;
(5)根据n(OH-)=2n[Ba(OH)2]计算;摩尔质量是单位物质的量的物质的质量,以“g/mol”为单位时,数值上与相对分子质量相等。
(1)设O2和O3的质量都为m,根据n=![]() ,O2和O3的物质的量之比为
,O2和O3的物质的量之比为![]() ∶
∶![]() =3∶2,根据N=n×NA,则所含分子个数之比为3∶2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其原子个数比为(3×2)∶(2×3)=1∶1,故答案为:3∶2;1∶1;
=3∶2,根据N=n×NA,则所含分子个数之比为3∶2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其原子个数比为(3×2)∶(2×3)=1∶1,故答案为:3∶2;1∶1;
(2)n[Al2(SO4)3]=c×V=0.4L×2.0mol/L=0.8mol,含Al3+的物质的量为0.8mol×2=1.6mol;400mL2.0mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度为2.0mol/L×3=6.0mol/L,稀释前后,硫酸根离子的物质的量不变,则c1V1=c2V2,c2=![]() =0.6mol/L,故答案为:1.6mol,0.6mol/L;
=0.6mol/L,故答案为:1.6mol,0.6mol/L;
(3)m(CH4)=nM=0.5 mol×16g/mol=8g,标准状况下,4.48LNH3的物质的量为![]() =0.2mol,含有的分子数为0.2mol×NAmol-1=0.2NA,故答案为:8g;0.2NA;
=0.2mol,含有的分子数为0.2mol×NAmol-1=0.2NA,故答案为:8g;0.2NA;
(4)1个CH4含有5个原子,1个N2含有2个原子,等物质的量的CH4和N2,分子个数相等,所含原子数之比为5∶2;依据n=![]() 可知,质量相等时,n与M成反比,所以等质量的CH4和N2物质的量之比为28g/mol∶16g/mol=7∶4,故答案为:5∶2;7∶4;
可知,质量相等时,n与M成反比,所以等质量的CH4和N2物质的量之比为28g/mol∶16g/mol=7∶4,故答案为:5∶2;7∶4;
(5)n(OH-)=2n[Ba(OH)2]=3.5mol×2=7mol,故OH-离子数目为7mol×NAmol-1=7NA;摩尔质量是单位物质的量的物质的质量,以“g/mol”为单位时,数值上与相对分子质量相等,因此NaOH的摩尔质量为40g/mol,故答案为:7NA;40g/mol。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是研究物质所含微粒集体的多少,单位为mol
B.物质的量把微观粒子数目与宏观物质的质量联系起来
C.1molNaCl晶体中含有NA个NaCl分子
D.12gC-12中所含的原子数为阿伏加德罗常数,NA近似为6.02×1023mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时有甲、乙、丙三种溶液,甲为0.1mol·L-1NaOH溶液,乙为0.1mol·L-1HCl溶液,丙为0.1 mol·L-1CH3COOH溶液,请回答下列问题:
(1)甲溶液的pH=___________________。
(2)乙溶液中由水电离出的c(H+)=___________________mol·L-1。
(3)写出丙的电离方程式_________________________________________________________,其电离平衡常数表达式Ka=___________________。
(4)向丙中加入乙,会_____________(“抑制”或“促进”)丙的电离,c(H+)_____________(填“增大”、“减小”或“不变”), 丙的电离平衡常数Ka_____________(填“增大”、“减小”或“不变”)。
(5)各取25 mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙) ____________V (丙)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18gmL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_________ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=_____mol·L-1。
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,以下说法正确的是
A. 标准状况下,11.2LH2O含H2O分子0.5NA
B. 1molFe与1molCl2充分反应转移电子3NA
C. 常温常压下,32g O2与O3的混合气中含氧原子2NA
D. 将0.1molFeCl3滴入沸水所形成胶体中含有氢氧化铁胶体粒子数目为 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1)![]() 键和
键和![]() 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:
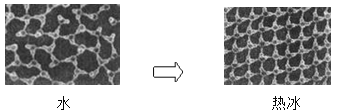
使水结成“热冰”采用“弱电场”的条件,说明水分子是______分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________g/cm3(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com