
| A. | 难溶于水的物质一定是非电解质 | B. | 液态氯化氢能导电 | ||
| C. | 液态氯化钠能导电 | D. | 熔融的液态钠是电解质 |
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ③②①④⑤ | C. | ③②⑤①④ | D. | ②③①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ④⑤ | C. | ②④⑥ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,5-三甲基己烷 | B. | 2,3 ___二甲基丁烷 | ||
| C. | 3,3,5,5-四甲基戊烷 | D. | 2,3-二甲基-2-乙基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②⑤⑦ | C. | ③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的气态氢化物比Y的气态氢化物稳定 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X原子的电子层数比Y原子的电子层数多 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

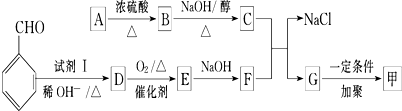
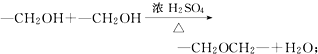

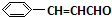 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2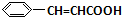 +H2O;
+H2O;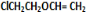 +
+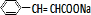 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$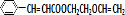 +NaCl.
+NaCl.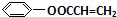 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com