
【题目】碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e-= C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:_________。
(2)工业炼铁时有如下副反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H>0,该反应能正向自发进行的原因是_________________。某温度时,把Fe和CO2放入体积固定的容器中,CO2 的起始浓度为2.0 molL-1,达到平衡后,CO的浓度为1.0 molL-1,则该温度下,该反应的平衡常数K=___________。如果平衡后,再通入一定量的CO,则CO2的物质的量分数将________________。(填编号)
FeO(s)+CO(g) △H>0,该反应能正向自发进行的原因是_________________。某温度时,把Fe和CO2放入体积固定的容器中,CO2 的起始浓度为2.0 molL-1,达到平衡后,CO的浓度为1.0 molL-1,则该温度下,该反应的平衡常数K=___________。如果平衡后,再通入一定量的CO,则CO2的物质的量分数将________________。(填编号)
A.增大 B.减少 C.不变
(3)己知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H>0的逆反应速率随时间变化的关系如下图,ti—升温,t2—达到平衡,请在图上画出ti—t3时的v(逆)的变化曲线。_______
FeO(s)+CO(g) △H>0的逆反应速率随时间变化的关系如下图,ti—升温,t2—达到平衡,请在图上画出ti—t3时的v(逆)的变化曲线。_______

(4)用间接化学法除去CO的过程如下图所示:己知电解池的阴极室中溶液的pH在4—6之间,写出阴极的电极反应式 ____________________________。

【答案】 6CO2(g)+6H2O(l)=C6H12〇6(s,葡萄糖)+6O2(g) △H=+2880kJmol-1 ΔS>0,高温条件可自发进行 1.0 C 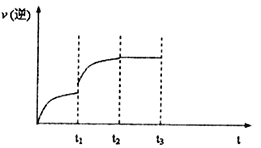 2HSO3-+2e_+2H+=S2O42-+2H2O
2HSO3-+2e_+2H+=S2O42-+2H2O
【解析】试题分析:(1)根据盖斯定律计算二氧化碳和水合成葡萄糖并放出氧气的焓变;
(2)影响反应方向的因素有焓变和熵变;利用“三段式”计算Fe(s)+CO2(g)![]() FeO(s)+CO(g)反应的平衡常数;再通入一定量的CO,平衡常数不变,CO、CO2的比例不变;(3)升温正逆反应速率均突然增大,平衡正向移动,所以ti—t2之间逆反应速率逐渐增大,t2达到平衡,ti—t2之间速率保持不变。(4)根据图示阴极2HSO3-得电子生成S2O42-。
FeO(s)+CO(g)反应的平衡常数;再通入一定量的CO,平衡常数不变,CO、CO2的比例不变;(3)升温正逆反应速率均突然增大,平衡正向移动,所以ti—t2之间逆反应速率逐渐增大,t2达到平衡,ti—t2之间速率保持不变。(4)根据图示阴极2HSO3-得电子生成S2O42-。
解析:(1)
① 2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
② 12(C3H6O3)+(s)+12e-= C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
根据盖斯定律,①×3+②得二氧化碳和水合成葡萄糖并放出氧气的热化学方程式6CO2(g)+6H2O(l)=C6H12〇6(s,葡萄糖)+6O2(g) △H=+2880kJmol-1;
(2)影响反应方向的因素有焓变和熵变,该反应吸热,根据焓变反应不能自发进行,所以该反应能正向自发进行的原因是ΔS>0,高温条件可自发进行;
Fe(s)+CO2(g)![]() FeO(s)+CO(g)
FeO(s)+CO(g)
开始 2.0 0
转化 1.0 1.0
平衡 1.0 1.0
![]()
反应的平衡常数;再通入一定量的CO,平衡常数不变,CO、CO2的比例不变,所以则CO2的物质的量分数将不变;(3)升温正逆反应速率均突然增大,平衡正向移动,所以ti—t2之间逆反应速率逐渐增大,t2达到平衡,ti—t2之间速率保持不变图像为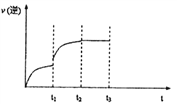 。
。
(4)根据图示阴极2HSO3-得电子生成S2O42-,电极反应为2HSO3-+2e_+2H+=S2O42-+2H2O。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:

(1)外电路的电子流方向是由__________极流向__________极。(填字母a或b)
(2)电池正极反应式为________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?__________(填“是”或“否”)原因是_______________。
(4)MnO2可与KOH和KClO4在高温条件下反应,生成K2MnO4,该反应的氧化产物和还原产物的物质的量比为________,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在水溶液中大量共存的是( )
A.I-、K+、ClO-、OH-B.Fe2+、H+、SO42-、NO3-
C.Al3+、K+、HCO3-、OH-D.Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com