
【题目】丙烯酸甲脂是—种重要的工业原料,某实验小组制取丙烯酸甲脂的装置如图所示: 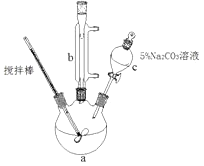
CH2=CHCOOH+HOCH3 ![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性。
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | ||
丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
回答下列问题:
(1)仪器b的名称是。
(2)混合液用5%Na2CO3溶液洗涤的目的是。
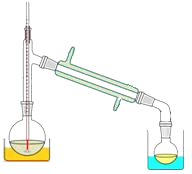
(3)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出、。![]()
![]()
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解。
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸18.00mL。
(4)计算本次酯化反应丙烯酸的转化率。
(5)请列举2条本实验中需要采取的安全防护措施、。
【答案】
(1)冷凝管
(2)除去混合液中的丙烯酸和甲醇(降低丙烯酸甲醇的溶解度)
(3)温度计水银球位置;尾接管与锥形瓶接口密封
(4)57.6%
(5)在通风橱中实验;防止明火
【解析】(1)用于冷凝回流反应混合物,仪器b的名称是冷凝管;
(2)混合液用5%Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲醇的溶解度);
(3)关于产品的蒸馏操作 中两处错误:温度计水银球位置、尾接管与锥形瓶接口密封;
(4)反应的丙烯酸(2.5mol/L×10.00mL-0.5mol/L的HCl×18.00mL)×5×10-3L/mL×72g/mol=5.76g,计算本次酯化反应丙烯酸的转化率:5.76g/10.0g×100%=57.6%。
(5)本实验中需要采取的安全防护措施:甲醇有毒,在通风橱中,实验防止明火。
故答案为:(1)冷凝管;(2)除去混合液中的丙烯酸和甲醇(降低丙烯酸甲醇的溶解度);(3)温度计水银球位置;尾接管与锥形瓶接口密封;(4)57.6%;(5)在通风橱中实验;防止明火;
(1)根据常用仪器的装置图、名称确定;
(2)丙烯酸能与Na2CO3反应、醇能溶于水;
(3)蒸馏时,温度计应置于支管口处,尾接管与锥形瓶接口不能密封;
(4)根据滴定过程消耗的KOH,确定参与酯化反应的丙烯酸的量,从而计算其转化率;
(5)甲醇有毒,且能燃烧;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出。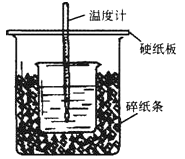
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤
B.①②③④
C.②③④⑤
D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”或“不相等”),所放出的热量(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会(填“偏大”、“偏小”或“无影响”).
(5)(Ⅱ)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: ![]() :
: ![]() kJ·mol-1 ,
kJ·mol-1 , ![]() :
: ![]() kJ·mol-1 ,
kJ·mol-1 , ![]() :
: ![]() kJ·mol-1 , 则反应P4(白磷) +3O2=P4O6的热化学反应方程式为。
kJ·mol-1 , 则反应P4(白磷) +3O2=P4O6的热化学反应方程式为。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式 。
(7)化学反应N2+3H2 ![]() 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是。
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是。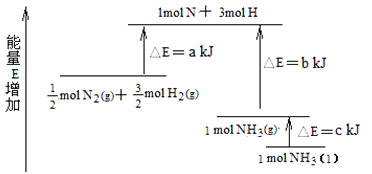
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 可加入硫酸以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.“低碳生活”有利于减缓全球气候变暖和环境恶化的速度
B.光导纤维的主要材料是晶体硅
C.云、雾、烟均能产生丁达尔现象
D.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以空气、海水中的物质为原料制取纯碱的工业流程:
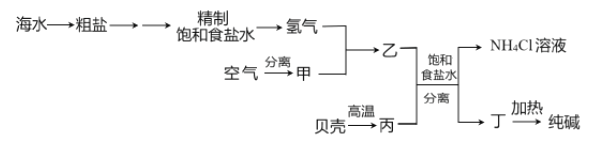
已知粗盐中含有Ca2+、Mg2+、SO42-等杂质离子。下列有关说法不正确的是
A. 除去粗盐中的杂质离子可依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液
B. 甲、丙分别为N2、CO2
C. 分离得到丁和NH4Cl溶液的操作是过滤
D. 上述流程中物质转化有涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用烃A合成高分子化合物N的流程如下图: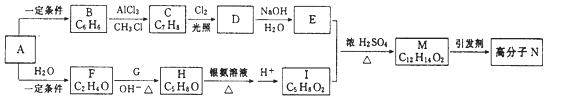
经测定烃A在标准状况下的密度为1.16g·L-1 , F和G是同系物,核磁共振氢谱显示有机物H中有四种峰,且峰值比为3:3:1:1。
已知:Ⅰ. 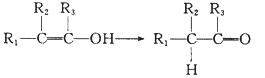
Ⅱ. ![]()
Ⅲ. 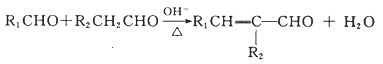 (R1、R2、R3代表烃基或氢原子)。
(R1、R2、R3代表烃基或氢原子)。
回答下列问题:
(1)写出A的结构简式:。
(2)H中所含官能团的名称是。
(3)H→I、M→N的反应类型分别是、。
(4)写出F和G反应生成H的化学方程式。
(5)E和I反应生成M的化学方程式为。
(6)芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成2-丙醇,则Q的种类有种。(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铜晶体的堆积方式说法正确的是( )
A. 按ABABAB……方式堆积,配位数为12 B. 按ABABAB…方式堆积,配位数为8
C. 简单立方堆积,配位数为6 D. 按ABCABC……方式堆积,配位数为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com