
【题目】下列关于反应过程中能量变化的说法正确的是( )
A.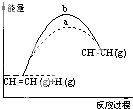 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
B.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2 . 则△H1>△H2
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.在一定条件下,某可逆反应的△H=+100kJmol﹣1 , 则该反应正反应活化能比逆反应活化能大100kJmol﹣1
【答案】D
【解析】解:A、依据催化剂能降低反应的活化能,图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂和未使用催化剂的变化曲线,反应过程中的能量变化,故A错误; B、一氧化碳燃烧生成二氧化碳会放热,焓变为负值,则△H1<△H2 , 故B错误;
C、同温同压下,反应的焓变只与起始和终了状态有关,与反应条件和变化途径无关,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故C错误;
D、图象分析正逆反应的活化能之差即为该反应的焓变数值,在一定条件下,某可逆反应的△H=+100kJmol﹣1 , 则该反应正反应活化能比逆反应活化能大100kJmol﹣1 , 故D正确.
故选:D.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】天津港爆炸致大量氰化钠(NaCN)泄露,NaCN是剧毒物质.专家们使用双氧水(H2O2)来处理氰化钠,反应方程式如下:H2O2+NaCN+H2O═NaHCO3+NH3
(1)若有0.49吨 NaCN泄露至少需要质量分数为34%的H2O2溶液吨进行处理 (假设H2O2的处理效果是100%,且不考虑H2O2自身分解)
(2)相比于双氧水,漂白粉(主要成分Ca(ClO)2)的价格要便宜的多,若处理相同质量的NaCN(生成物相同)需要消耗Ca(ClO)2mol(假设Ca(ClO)2的处理效果是100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铜与浓硫酸的反应下列说法错误的是
A. 该反应中氧化剂与还原剂物质的量之比为1:1
B. 浓硫酸在反应中既体现出氧化性,又体现出酸性
C. 标准状况下,lmol铜和2mol浓硫酸充分反应可得22.4L气体
D. 1mol铜和足量浓硫酸反应,转移电子个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A. Ag+、K+、NO3﹣、Cl﹣ B. Mg2+、Na+、Cl﹣、SO42﹣
C. Ca2+、Mg2+、OH﹣、Cl﹣ D. H+、Na+、CO32﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程如图1和实验装置如图2: 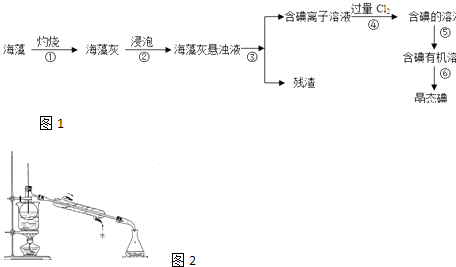
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ , 步骤⑤ .
(2)写出步骤④对应反应的离子方程式:
(3)提取碘的过程中,可供选择的有机试剂是(填编号)
A.醋酸
B.苯
C.四氯化碳
D.酒精
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 .
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1 molH2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJmol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJmol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌与100mL 18.5mol/L H2SO4充分反应后,锌完全溶解,同时生成气体A 22.4L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn 65g
C.气体A中SO2和H2的体积比为1:4
D.反应中共转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对的电子总数等于未成对的电子总数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.
(1)A,C形成的分子极易溶于水,与该分子互为等电子体的阳离子为 .
(2)比较E、F的第一电离能:E(填“>”或“<”)F.
(3)BD2在高温高压下所形成的晶胞如图所示.该晶体的类型属于(填“分子”“原子”“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 . 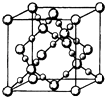
(4)单质F与强碱溶液反应有[F(OH)4]﹣生成,则[F(OH)4]﹣中存在(填字母). a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(5)Cu晶体是面心立方体,立方体的每个面5个Cu原子紧密堆砌,已知每个Cu原子的质量为a g,Cu原子半径为d cm,求该晶体的密度为gcm﹣3 . (用含a、d的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com