

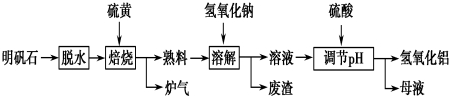
分析 过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄,
(1)废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解;
(2)流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,结合原子守恒和电子守恒配平书写化学方程式;
(3)检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净;
(4)①氧化过程若温度太高,会导致产品颜色偏红,依据铁的化合物中 呈红色的物质分析;
②氧化时应控制pH的合理范围是保证产率最高,pH过小导致产率较低是酸性增强,氧化铁黄会溶解于酸中;
解答 解:过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄,
(1)废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解,易于洗涤,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,同时生成硫酸钠和水,结合原子守恒和电子守恒配平书写化学方程式为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O,
故答案为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O;
(3)检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净,检验洗涤是否完全的方法是,取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净,
故答案为:取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净;
(4)①氧化过程若温度太高,会导致产品颜色偏红,依据铁的化合物中呈红色的物质为氧化铁、氢氧化铁,可能含有的杂质是Fe2O3或Fe(OH)3,
故答案为:Fe2O3或Fe(OH)3;
②氧化时应控制pH的合理范围是保证产率最高,此时的PH范围依据图象分析可知为:3.5~4.0,pH过小导致产率较低是酸性增强,氧化铁黄会溶解于酸中,
故答案为:3.5~4.0,PH过低导致氧化铁黄部分溶于酸;
点评 本题考查了物质的分离和提纯,流程分析判断,主要是物质性质的理解应用,注意实验基本操作的掌握,主要是图象的分析和判断,题目难度中等.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KMnO4被氧化 | |
| B. | 反应中得到电子的物质是Cl2 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 被还原的HCl占参加反应HCl物质的量的3/8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的离子半径比X的离子半径大 | |
| B. | 化合物Y2Z中既有离子键、又有共价键 | |
| C. | Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝 | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
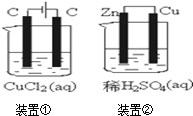
| A. | 两个装置中都发生了化学变化,都由化学能转变为电能 | |
| B. | 装置②中电流方向是从Zn经导线流入Cu | |
| C. | 反应开始阶段,两个装置中均有氢气产生 | |
| D. | 电极反应式:阳极2Cl--2e-→Cl2↑正极2H++2e-→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com