
����Ŀ�������仯�������ճ�����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
(1)������Ԫ��ֻ�л�ԭ�Ե�������_________��
A��Fe B��FeCl2 C��FeCl3 D��Fe2O3
(2)������ȱ��ʱ��������Ҫ�Բ�������Ʒ�������ܹ����յ���+2�۵���������+2�۵��������ױ�������
����μ���ij���岹��������Ԫ���ѱ�������д���������̡������ۡ�
��____________________________________________________________________��
�ڷ���ά����C����ʹʳ���е�����������ת��Ϊ���������ӡ��ɴ˿���֪��ά����C����________________(�ѧ����)��
(3) �������(K2FeO4)��һ�����͡���Ч�������ɫˮ��������ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ������������Fe(OH)3��C1O-��OH-��FeO42-��Cl-��H2O��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)��ҵ�����Ȼ�����ʴͭ���������·�塣ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ��������Ȼ������壬���������в��裺
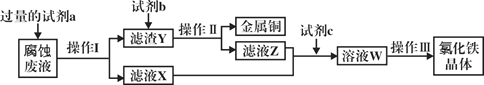
�ش���������:
���Լ�a��___________������I�õ��IJ����������ձ�����������___________��
����ҺX��Z�ж���ͬһ�����ʣ�����ת��Ϊ��ҺW�����ӷ���ʽΪ___________��
�����������в���III����________________��________________�����ˡ�ϴ�ӡ�
���𰸡�A ��ϸ���������ܽ⣬����KSCN��Һ������Һ���ɫ��˵���ѱ����� ��ԭ�� 2 3 4OH- 2 3 5H2O ��(Fe) ©�� 2Fe2++Cl2==2Fe3++2Cl- ����Ũ�� ��ȴ�ᾧ
��������
��1����Ԫ�ش�����ͼ�̬ʱ��ֻ�ܱ��ֻ�ԭ�ԣ��������ԡ�����Ϊ����Ԫ�أ��仯�ϼ���ͼ�Ϊ0�ۣ����Դ�ѡA�
��2���ٸ��������Fe3+�ļ������⡣��Ϊ��Ʒ�ǹ���״̬������������Ҫ��ϡ�����ϡ�����ܽ⣬Ȼ��μ�KSCN��Һ�������Ѫ��ɫ��Һ��˵�����岹��������Ԫ���ѱ�������������������˵���ù��岹��������Ԫ����δ��������
�ڼ���ά����C��ʵ����Fe3+��ΪFe2+�������˻�ԭ��Ӧ������ά�����ǻ�ԭ���������˻�ԭ�ԣ�
��3����Ŀ�Ѹ����μ�������ԭ��Ӧ�����Ͷ�Ӧ�����������ԭ��������ȷ������ϼ۱仯�������Fe(OH)3��FeO4-ǰ��2��ClO-��Cl-ǰ��3����֤��ʧ�����غ㡣Ȼ��Ⱥ�����ĵ�������������4��OH-�����غ㣬������Ҳ���5��H2OʹHԭ���غ㡣
��4����ҵ�����Ȼ�����ʴͭ����ʴ��Һ����Ҫ�ɷ���FeCl3��FeCl2��CuCl2��Ϊ�˻���ͭ������뻹ԭ����ʹͭ����Һ��������Ϊͬʱ����Ȼ�������ͨ����������FeCl2����ΪFeCl3��
���Լ�aΪ��������������Iʵ���˹̡�Һ���룬Ӧ�ǹ��˲�����ʵ������Ҫ�IJ������������ձ��Ͳ������⣬����Ҫ��ͨ©����
����ҺX��Z�ж���FeCl2����ҺW��FeCl3��Һ����ҵ��ͨ��ͨ�����������ʵ����������������Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+Cl2=2FeCl3����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-��
�����������в���III�Ǵ�FeCl3��Һ�л�þ���IJ�����ͨ����Ҫ������Ũ��ʹ��Һ��Ϊ���ͣ�������ͣ���Һ��Ȼ���£���ȴ���ᾧ�����˺��ٽ���ϴ�ӡ�����ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪԭ�������������������Ԫ�أ�A2����B��������ͬ�ĵ��ӹ��ͣ�C��DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӡ��ش��������⣺
��1������Ԫ���е縺��������________(��Ԫ�ط���)������Cԭ�ӵĺ�������Ų�ʽΪ__________________��
��2������A������ͬ�������壬���зе�ߵ���______(�����ʽ)��ԭ����__________________________________________��A��B���⻯�������ľ������ͷֱ�Ϊ________��________��
��3��C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E��E�����幹��Ϊ______________������ԭ�ӵ��ӻ��������Ϊ________��
��4��������D2A�����幹��Ϊ________������D��ʪ���Na2CO3��Ӧ���Ʊ�D2A���仯ѧ����ʽΪ_______________________________________________��
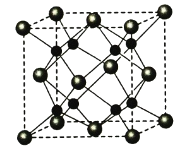
��5��A��B�ܹ��γɻ�����F���侧���ṹ��ͼ��ʾ����������a��0.566 nm��F�Ļ�ѧʽΪ________������F���ܶ�(g��cm��3 )________________________________�����г�����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܷ���������Ӧ��������ụΪͬ���칹���������
A. ��ȩB. ��������C. �������D. ��ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ���ȫ����ȷ��������
A. CO��������������CaO��������������
B. ��ˮ�������������ﵨ������������
C. �ռ�����������������
D. NaHSO4����һԪ�� BaSO4����ǿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C60�ǵ���ѧ���ע���ȵ�����֮һ�����ǽ��ʯ��ʯī��( )
A. ͬ��������B. ͬ���칹��C. ͬλ��D. ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Al2(SO4)3��K2SO4��KAl(SO4)2����������ɵĻ����Һ�У�K����Ũ��Ϊ0.25mol/L����������0.20mol/L��KOH��Һ��ʹ���ɵİ�ɫ����ǡ���ܽ⣬��ôԭ��Һ��SO42-��Ũ���ǣ� ��
A. 0.20mol/L B. 0.25mol/L C. 0.225mol/L D. 0.45mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��Һ��ֻ������K+��Mg2+��AlO2����SiO32����CO32����SO42���е����������ӣ�ijͬѧ����Һ��������ͼʵ�飺�����жϴ������( )

A. ����������ɣ�������ҺX��һ������CO32��
B. ���������ǹ���þ
C. K+һ����������ҺX��
D. ����ȷ��SO42���Ƿ��������ҺX��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��U�ι���ʢ���Ȼ�ͭ��Һ�����������鴿пƬ���缫������ͼ��
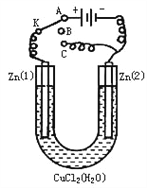
��1������ѵ��K��A����һװ���γ�_________װ�ã�Zn�ٵ缫��Ӧʽ��________________________��
��2��������Ӧ����5min��ת�����K��C����һװ���γ�____________װ�ã�Zn�ټ���____������װ�÷�����Ӧ������ѧ����ʽ�� ________________________��
��3������װ�ý���2min����ת�����K��B����Zn�ڼ��Ϸ����ĸ�ʴ����_______������ʴ�Ľ�����______________��Zn�ټ������ĸ�ʴ��Ҫ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ����̼����������Ϊ��ѧ���о�����Ҫ���⡣��ش��������⣺
��.��������������һ���Ƚ������ⷽ�����䷴Ӧ����ʽΪCH4(g)��H2O(g)![]() CO(g)��3H2(g)��
CO(g)��3H2(g)��
(1)�Ķ���ͼ������������Ӧ�ķ�Ӧ����H��________kJ��mol��1��

��.��CH4�������л��O2Ϊԭ�Ͽ���Ƴ�ȼ�ϵ�ء�
(2)��CnH2nOn��O2Ϊԭ�ϣ�H2SO4��ҺΪ�������Ƴ�ȼ�ϵ�أ����ĵ缫��ӦʽΪ________________________________________________________________________��
(3)��CH4��O2Ϊԭ�ϣ�100mL0.15mol��L��1NaOH��ҺΪ�������Ƴ�ȼ�ϵ�أ����ŵ�ʱ���뷴Ӧ���������Ϊ448mL(��״��)������������ȫ������Һ���գ���������Һ�����ʵijɷּ����ʵ���֮��Ϊ________________________��������Ũ���ɴ�С��˳��Ϊ________________________________________________________________________��
��.����I2O5����CO��Ⱦ�ķ�ӦΪ5CO(g)��I2O5(s)![]() 5CO2(g)��I2(s)����ͬ�¶��£���װ������I2O5�����2L�����ܱ�������ͨ��4molCO�����CO2�����������ʱ��t�仯��������ͼ����ش�
5CO2(g)��I2(s)����ͬ�¶��£���װ������I2O5�����2L�����ܱ�������ͨ��4molCO�����CO2�����������ʱ��t�仯��������ͼ����ش�
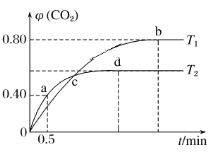
(4)T2ʱ��0��0.5min�ڵķ�Ӧ����v(CO)��________________��
(5)T1ʱ��ѧƽ�ⳣ��K��________��
(6)����˵������ȷ����________�����ţ���
A�������������ܶȲ��䣬������Ӧ�ﵽƽ��״̬
B�������¶��£�c��ʱ��ϵ�л�������ѹǿ���
C��d��ʱ��������ϵѹǿ��CO��ת���ʲ���
D��b���d��ʱ��ѧƽ�ⳣ���Ĵ�С��ϵ��Kb<Kd
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com