
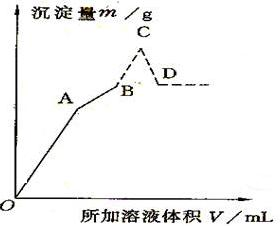
| A | B | C | D | |
| V[Ba(OH)2 (aq)]/ml | ||||
| V[HCl(aq)]/ml | ||||
| M沉淀/g |
| 3 |
| 4 |
| 3 |
| 2 |
| 0.015mol |
| 0.1mol/L |
| 1 |
| 2 |
| 0.01mol |
| 0.1mol/L |
| 0.02mol |
| 0.5mol/L |
| 0.03mol |
| 0.5mol/L |
| A | B | C | D | |
| V[Ba(OH)2(aq)/mL | 150 | 100 | ||
| V[HCl(aq)]/mL | 40 | 60 | ||
| M沉淀/g | 4.275 | 4.66 | 5.055 | 4.66 |


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| A、反应①和②的氧化产物都是S02 |
| B、反应①的氧化产物与还原产物物质的量之比为1:1 |
| C、等物质的量的硫化亚铜在反应①和②中完全反应,转移的电子数相等 |
| D、反应②中,硫化亚铜既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C(H+)?C(CH3COO-) |
| C(CH3COOH) |
| C(H+)?C(HS-) |
| C(H2S) |
| C(H+)?C(S2-)2- |
| C(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

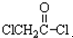 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
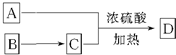 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
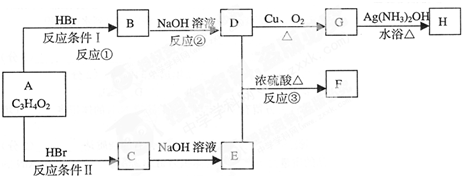
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com