
【题目】最早使用的化学电池是锌锰电池,即大家熟悉的干电池,其结构如图所示。

尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NH4+===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NH4+===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=Q kJ·mol-1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
CH3OH(g) ΔH=Q kJ·mol-1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
温度(℃) | 容器体积 | CO转化率 | 平衡压强(p) | |
① | 200 | V1 | 50% | p1 |
② | 200 | V2 | 70% | p2 |
③ | 350 | V3 | 50% | p2 |
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器体积V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率<70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O![]() 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验 编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
① | 4 | 60 | 10 | 30 |
② | 5 | 60 | 10 | 30 |
③ | 5 | 60 | _________ | _________ |
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。

(2)上述反应后草酸被氧化为__________________(填化学式)。
(3)实验①和②的结果表明____________________;实验①中0~t1时间段反应速率v(Cr3+)=____________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:___________________________;
假设三:___________________________;
(5)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O![]() 的浓度可用仪器测定]
的浓度可用仪器测定]
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
_____________ |
(6)某化学兴趣小组要完成中和热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是___、_____。
(7)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。计算完成上表中的ΔH_________________________。
(8)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果ΔH____(填“偏大”或“偏小”无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+ H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加炭的量
B.将容器的体积缩小一半
C.保持体积不变,充入一定量的水(g)
D.保持压强不变,充入氮气使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镁、金等的相关物质在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是___________,基态铜原子中,核外电子占据最高能层的符号是___________,占据该最高能层的电子数为___________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、 Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___________(填“晶体”或“非晶体”)
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,lmol(SCN)2分子中含有σ键的数目为___________。(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________________________。
(4)铜与金形成的金属互化物的晶胞结构如图1所示,其晶胞边长为anm,该金属互化物的密度为___________(用含a、NA的代数式表示)g·cm-3。

(6)某金属晶体中原子的堆积方式为六方最密堆积如图2所示,晶胞可用图3表示。已知该金属的原子半径为acm,该金属晶胞的高为bcm:若以晶胞中A点原子为原点建立空间直角坐标系o-xyz,则A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论或解释 |
A | 向盛有漂白粉溶液的试管中加入浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
B | 向SO2 水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO3 |
C | 使装有NO2 气体的密闭容器减小体积 | 气体颜色先变深而后变浅 | 气体颜色变浅的原因是2NO2 =N2O4 正向移动 |
D | 先向2mL0.1mol/LNa2S 溶液中滴入几滴0.1mol/LZnSO4 溶液,再加入几滴CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积Ksp:ZnS>CuS |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
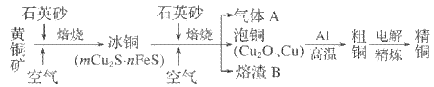
A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com