
【题目】下列能达到实验目的的是
A. 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 在用稀硫酸和锌粒反应制取氢气时可以适当加热以加快化学反应速率
C. 向煮沸的l mol·L-1 NaOH溶液中滴加FeC13饱和溶液制备Fe(OH)3胶体
D. 称取19.0g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnC12溶液
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】如图形象地表示氯化钠的形成过程。下列相关的叙述中不正确的是( )

A.钠原子易失去一个原子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用形成![]() 后,其结构的稳定性增强
后,其结构的稳定性增强
D.氯化钠中微粒之间形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1.01x105Pa时,将1L丙烷与若干升O2混合点燃充分燃烧后,恢复至原温度、压强,测得气体体积为aL,通过碱石灰后气体体积变为bL。
(1)若a-b=7, 则bL气体中一定含有____。
(2)若a-b=5,则混合前O2体积是______,点燃前混合气体的平均摩尔质量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程_____________
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是_____________(写化学式)。
(3)配平下列反应方程式,并标出电子转移方向和数目___________。
Fe2++ O2 + H+== Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为___________L。
(4)通入二氧化碳的目的是_____________和______________。
(5)Cl2的作用是_____________________________。
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
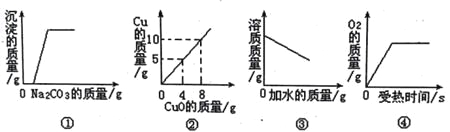
A. 图①是向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量
B. 图②是用H2还原CuO来测定CuO中铜元素的含量
C. 图③是向饱和的NaCl溶液中不断加水
D. 图④是用适量的KClO3和MnO2混合物加热制O2
查看答案和解析>>
科目:高中化学 来源: 题型:
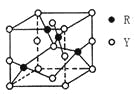
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )

A. 充电时,![]() 嵌入
嵌入![]() 中
中
B. 放电时,![]() 极发生的电极反应为
极发生的电极反应为![]()
C. 放电时负极反应为:![]()
D. 充电时,若转移![]() ,石墨烯电极增重7g
,石墨烯电极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com