
【题目】25℃ 时,向体积均为20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ溶液中分别逐滴加入0.1000mol·L-1的NaOH溶液,所得溶液的pH与加入NaOH溶液的体积关系如图所示。下列说法正确的是( )
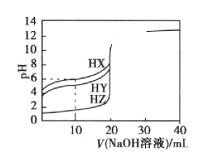
A.当V(NaOH溶液)=0mL时,三种溶液相比较c(X-)>c(Y-)>c(Z-)
B.当三种溶液pH均等于7时,反应消耗的n(HX)>n(HY)>n(HZ)
C.当V(NaOH溶液)=10mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+)
D.HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
科目:高中化学 来源: 题型:
【题目】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________,其氢化物的电子式__________。
(2)![]() 、Z、Q三种元素的原子半径由大到小的顺序__________
、Z、Q三种元素的原子半径由大到小的顺序__________![]() 用元素符号表示
用元素符号表示![]() 。
。
(3)![]() 元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________
元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________![]() 填字母序号
填字母序号![]() 。
。
![]() 过渡元素区域
过渡元素区域
![]() 金属和非金属元素的分界线附近
金属和非金属元素的分界线附近
![]() 含有氟、氯、硫、磷等元素的区域
含有氟、氯、硫、磷等元素的区域
![]() 下列能说明Y与R元素非金属性相对强弱的是__________。
下列能说明Y与R元素非金属性相对强弱的是__________。
![]() 单质与氢气化合的难易程度
单质与氢气化合的难易程度
![]() 含氧酸的酸性:
含氧酸的酸性:![]()
![]() 与R相互形成的化合物中元素的化合价
与R相互形成的化合物中元素的化合价
Ⅱ![]() 已知:
已知:
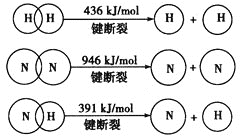
合成氨的热化学方程式是___________________________________。
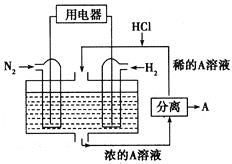
Ⅲ![]() 有人设想以
有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为________mol·L-1·min-1;此反应在该温度下的平衡常数为________;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________。
(3)一定条件下,发生反应③,原料气中![]() 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。

结合图像,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________;
b:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:

则该反应的△H=___________kJ·mol-1
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为:CO(g)+2H2(g) CH3 OH(g) △H<O
在一定条件下,将1 mol CO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH2OH的体积分数![]() (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___________。
②某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)合成甲醇所需的氢气,工业上常从一种合成气(主要成分为CO2、H2)中分离。H2提纯过程示意图如下:

①吸收池中发生反应的离子方程式是___________。
②用电极反应式和离子方程式表示K2CO3溶液的再生原理___________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) 2HI(g)的△H=___________0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-I3-,图2中曲线b代表的微粒是___________(填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液呈弱酸性。在0.1mol/L NaHSO3溶液中,下列粒子浓度关系式不正确的是( )
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2SO3)
)>c(H2SO3)
B.c(H+)+c(![]() )=c(OH-)+c(H2SO3)
)=c(OH-)+c(H2SO3)
C.c(Na+)=c(![]() )+c(H2SO3)+c(
)+c(H2SO3)+c(![]() )
)
D.c(H+)+c(Na+) =c(OH-)+c(![]() )+2c(
)+2c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a 图b
图b
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
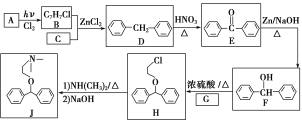
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___________,H中的官能团名称是_________________。
(2)由D生成E的反应类型是________,G的结构简式为_______________。
(3)B+C―→D的化学方程式为_____________________________________。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
)结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
(5)写出用氯乙烷和2氯1丙醇为原料制备化合物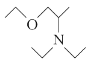 的合成路线(其他无机试剂任选)。________________
的合成路线(其他无机试剂任选)。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:

说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是___________,Y是___________,Z是____________(填化学式,下同)。
(2)当X是强酸时,E是_______________,写出B生成C的化学方程式:__________________。
(3)当X是强碱时,E是_______________,写出D生成E的离子方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com