

| A. | 氧化反应与化合反应属于并列关系 | B. | 单质与化合物属于交叉关系 | ||
| C. | 化合物与氧化物属于包含关系 | D. | 纯净物与混合物属于包含关系 |
分析 A.某些化合反应中存在元素的化合价变化;
B.纯净物包含单质、化合物;
C.氧化物一定为化合物;
D.物质分为纯净物、混合物.
解答 解:A.某些化合反应中存在元素的化合价变化,有化合价变化的反应为氧化还原反应,可知氧化反应与化合反应为交叉关系,故A不选;
B.纯净物包含单质、化合物,可知单质与化合物属于并列关系,故B不选;
C.氧化物一定为化合物,则化合物与氧化物属于包含关系,故C选;
D.物质分为纯净物、混合物,则纯净物与混合物属于并列关系,故D不选;
故选C.
点评 本题考查化学反应分类及物质分类,为高频考点,把握物质的分类及反应分类依据为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
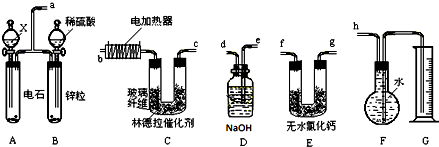
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
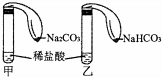 为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).
为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下NaHCO3比Na2CO3更 稳定 | |
| B. | 向等量的Na2CO3和NaHCO3固体中分别滴加同浓度的盐酸,后者产生气泡速率快 | |
| C. | 相同条件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 经实验测定,Na2CO3溶液显碱性,说明Na2CO3属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
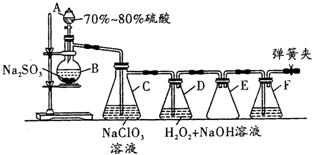 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: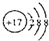 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: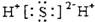 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
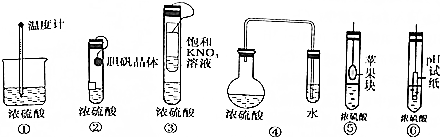
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com